
| A、从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
| B、向Mg(HCO3)2溶液中加入过量的澄清石灰水:Mg2++2HCO3-+2OH一+Ca2+═MgCO3↓+CaCO3↓+2H2O |
| C、乙烯的燃烧热为akJ/mol(a>0),则乙烯燃烧的热化学方程式可表示为:C2H4(g)+3O2(g)═2CO2(g)+2H2O(g)△H=-akJ/mol |
| D、Ba(OH)2溶液中加入过量的Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ |


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:
| A、化学反应速率只能用一定时间内反应物浓度的减少来表示 |
| B、化学反应速率的大小主要取决于反应物的性质 |
| C、化学反应达到最大限度时,正逆反应速率也达到最大且相等 |
| D、用铁片和稀硫酸反应制取氢气时改用98%浓硫酸可以加快产生氢气的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 | B、2.3 |
| C、2.6 | D、2.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、pH=1的溶液中K+ CrO
| ||||||
B、饱和氯水中Cl- NO
| ||||||
C、能使pH试纸变红的溶液NH
| ||||||
D、FeCl2溶液中K+ Na+ SO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c (K+)+c (H+)=c (HC2O4-)+c (OH-)+c (C2O42-) |
| B、c (C2O42-)<c (H2C2O4) |
| C、c (HC2O4-)+c (C2O42-)=0.1 mol?L-1 |
| D、c (K+)=c (H2C2O4)+c (HC2O4-)+c (C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
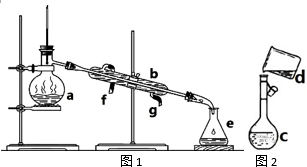 掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com