
 前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题: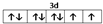 .
.分析 前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有一个,并且A-和B+的电子数相差为8,A属于第VIIA族元素,B属于第IA族元素,且A的原子序数小于B,则A是F元素,B是K元素;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,且C和D的原子序数大于B,C的原子序数小于D,则C是Fe元素,D是Ni元素.
解答 解:前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有一个,并且A-和B+的电子数相差为8,A属于第VIIA族元素,B属于第IA族元素,且A的原子序数小于B,则A是F元素,B是K元素;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,且C和D的原子序数大于B,C的原子序数小于D,则C是Fe元素,D是Ni元素,
(1)Ni2+的价层电子为3d电子,根据能量最低原理、保里不相容原理及洪特规则知,其价电子排布图为 ,
,
故答案为: ;
;
(2)元素的金属性越强其第一电离能越小,元素的非金属性越强,其电负性越大,这四种元素中金属性最强的是K元素,非金属性最强的元素是F,所以第一电离能最小的是K,电负性最大的是F,
故答案为:K;F;
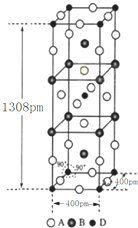
(3)①该晶胞中F原子个数=16×$\frac{1}{4}$+4×$\frac{1}{2}$+2=8,K原子个数=8×$\frac{1}{4}$+2=4,Ni原子个数=8×$\frac{1}{8}$+1=2,所以该化合物的化学式为K2NiF4,
故答案为:K2NiF4;
②该晶胞的体积=(400×10-10cm)2×(1308×10-10cm),晶胞质量=$\frac{39×4+59×2+19×8}{6.02×1{0}^{23}}$g,故晶体密度=$\frac{\frac{39×4+59×2+19×8}{6.02×1{0}^{23}}g}{(400×1{0}^{-10}cm)^{2}×1308×1{0}^{-10}cm}$=3.4g•cm-3,
故答案为:3.4;
(4)F-、K+和Fe3+三种离子组成的化合物K3FeF6,Fe3+含有空轨道,为中心离子,F-含有孤对电子,为配体,二者之间形成配位键,形成配离子[FeF6]3-,[FeF6]3-与K+之间形成离子键,
故答案为:离子键、配位键;[FeF6]3-;F-.
点评 本题考查物质结构和性质,正确推断元素是解本题关键,难度中等,注意化学式的确定中各原子被几个晶胞共用,为易错点,难点是密度的计算.


科目:高中化学 来源: 题型:选择题
| A. | 铜与硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| B. | 铁在氯气中燃烧:2Fe+3Cl2═2Fe3++6Cl- | |
| C. | 硫酸铜溶液中滴加氢氧化钡溶液:SO42-+Ba2+═BaSO4↓ | |
| D. | 氧化铝与稀盐酸混合:Al2O3+6H+═2Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO2 | B. | BeCl2 | C. | BF3 | D. | XeF2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层电子数:Z>R>Y | |
| B. | 气态氢化物的稳定性:Y<Z | |
| C. | R、X的氧化物均为离子化合物 | |
| D. | X和Y两者最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
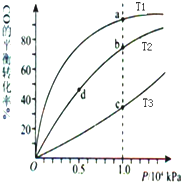
| A. | 温度:T1>T2>T3 | B. | 平衡常数:K(a)>K(c) K(b)=K(d) | ||
| C. | 正反应速率:v(a)>v(c) v(b)>v(d) | D. | 平均摩尔质量:M(a)<M(c) M(b)>M(d) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用胶头滴管加液时,不能伸入试管中 | |
| B. | 蒸馏盛在烧瓶中含水的酒精,需在瓶内放一些碎瓷片 | |
| C. | 萃取实验中涉及气体压强原理 | |
| D. | 用容积为100 mL的量筒量取80 mL无水乙醇,使液面最低点至刻度80 mL处 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 通空气时,铜被腐蚀,表面产生CuO | |
| B. | 放电时,Li+透过固体电解质向Cu极移动 | |
| C. | 放电时,正极的电极反应式为Cu2O+H2O+2e-═2Cu+2OH- | |
| D. | 整个反应过程中,铜相当于催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com