
把Ba(OH)2溶液滴入到明矾溶液中,使SO42﹣全部转化成BaSO4沉淀,此时铝元素的主要存在形式是()
A. Al3+ B. Al(OH)3 C. AlO2﹣ D. Al3+和Al(OH)3
考点: 镁、铝的重要化合物;离子方程式的书写.
专题: 离子反应专题.
分析: 明矾的化学式为KAl(SO4)2•12H2O,设明矾为1mol,则溶液中含有1molAl3+,2molSO42﹣,根据反应:SO42﹣+Ba2+=BaSO4↓,Al3++4OH﹣=AlO2﹣+2H2O判断.
解答: 解:明矾的化学式为KAl(SO4)2•12H2O,设明矾为1mol,则溶液中含有1molAl3+,2molSO42﹣,由反应SO42﹣+Ba2+=BaSO4↓可知,使SO42﹣全部转化成BaSO4沉淀,需要2molBa(OH)2,则加入4molOH﹣,则发生Al3++4OH﹣=AlO2﹣+2H2O,所以最后溶液中存在AlO2﹣,
故选C.
点评: 本题考查离子方程式的书写,题目难度中等,本题中注意判断使SO42﹣全部转化成BaSO4沉淀需要Ba(OH)2的物质的量,根据Al3+和OH﹣物质的量的关系判断反应产物.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
在2L密闭容器中进行如下反应:N2+3H2 2NH3,5min内氨的质量增加了1.7g,则反应速率为()
2NH3,5min内氨的质量增加了1.7g,则反应速率为()
A. V(NH3)=0.02mol.(L.min)﹣1 B. V(NH3)=0.01mol.(L.min)﹣1
C. V(N2)=0.01mol.(L.min)﹣1 D. V(H2)=0.03mol.(L.min)﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
在强酸性溶液中能大量共存并且溶液为无色透明的离子组是()
A. NH4+、Al3+、SO42﹣、NO3﹣ B. K+、Na+、AlO2﹣、NO3﹣
C. K++、NH4+、MnO4﹣、SO42﹣ D. Na+、K+、NO3﹣、HSO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
铝可与硝酸钠发生反应:Al+NaNO3+H2O→Al(OH)3↓+N2↑+NaAlO2(未配平),下列有关上述反应的叙述正确的是()
A. 该反应中的氧化剂是水
B. 若反应过程中转移5 mol电子,则生成标准状况下N2的体积为11.2 L
C. 该反应中的氧化产物是N2
D. 当消耗1 mol Al时,生成标准状况下N2的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列不能由单质直接通过化合反应制取的是()
①FeCl2 ②FeCl3③FeS ④Mg3N2 ⑤CuS ⑥Al2S3 ⑦AlCl3.
A. ①③ B. ①④ C. ①⑤ D. ①⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用4mol SO2与2mol O2进行下列反应:2SO2(g)+O2(g)⇌2SO3(g);△H=﹣196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为()
A. 40% B. 50% C. 80% D. 90%
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂排出的污水中含有大量的Fe2+、Zn2+、Hg2+三种金属离子。以下是某化学研究性学习小组的同
学设计除去污水中的金属离子,并回收绿矾、皓矾(ZnSO4·7H2O)和汞的方案。
【药品】 NaOH溶液、 硫化钠溶液、硫化亚铁、稀硫酸、铁粉
硫化钠溶液、硫化亚铁、稀硫酸、铁粉
【实验方案】
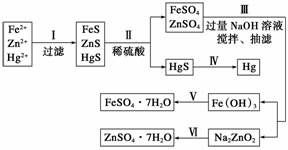
【问题探究】
(1)步骤Ⅱ所发生反应的离子方程式为__________________________________。
(2)步骤Ⅲ中抽滤的目的是____________,该步骤产生Fe(OH)3的反应的离子方程式为
_______________________________________________________________________。
(3)步骤Ⅵ中得到硫酸锌溶液的离子方程式为_________________________________________。
(4)欲实现步骤Ⅴ,需加入的试剂有________、________,所涉及的主要操作依次为_____________。
(5)步骤Ⅳ常用的方法是________,该步骤是否对环境有影响?________(填“是”或“否”),如有影响,请你设计一个绿色环保方案来实现步骤Ⅳ的反应:__________。
(6)该研究小组的同学在强碱溶液中,用次氯酸钠与Fe(OH)3反应获得了高效净水剂Na2FeO4,该反应的离子方程式为___________________________ ____________。
____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com