
| A. | 通入大量 NO,ν 正、ν 逆 均增大 | |
| B. | 恒温恒容下充入 Ne,ν 正、ν 逆 均不变 | |
| C. | ν 正(NO)=2ν 逆(N2)时,反应达到平衡 | |
| D. | n (NO):n (CO):n (N2):n (CO2)=2:2:1:2 时,反应达到平衡 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、增加反应物一氧化氮的量,正、逆反应速率都加快,故A正确;
B、恒温恒容下充入 Ne,反应体系中各组份的浓度不变,所以ν 正、ν 逆 均不变,故B正确;
C、ν 正(NO)=2ν 正(N2)=2ν 逆(N2),所以正、逆反应速率相等,达平衡状态,故C正确;
D、当体系达平衡状态时,n (NO):n (CO):n (N2):n (CO2)可能为2:2:1:2,也可能不是,与各物质的初始浓度及转化率有关,故D错误;
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子式为C3H6的有机物最多存在3个碳碳单键,与C4H10的碳碳单键数相同 | |
| B. |  和 和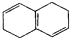 均是芳香烃, 均是芳香烃,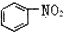 是芳香族化合物 是芳香族化合物 | |
| C. | 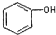 和 和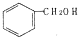 分子组成相差一个-CH2-,因此是同系物 分子组成相差一个-CH2-,因此是同系物 | |
| D. | 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式为C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 欲将蛋白质从水中析出而又不改变它的性质,可加入AgNO3溶液 | |
| B. | 乙醇可以被氧化为乙酸,二者都能发生酯化反应 | |
| C. | 淀粉溶液中加入一定量稀硫酸,共热一段时间后,向溶液中加入新制氢氧化铜悬浊液并加热煮沸,未见红色固体产生,证明淀粉没有发生水解 | |
| D. | 可用NaOH溶液除去混在乙酸乙酯中的乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.
有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH固体 | B. | NaCl固体 | C. | H2O | D. | CaCO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石晶体中的最小碳原子环由6个碳原子构成 | |
| B. | 金刚石晶体中的碳原子是sp2杂化的 | |
| C. | 12g金刚石中含有C-C键的个数为4NA | |
| D. | 金刚石化学性质稳定,即使在高温下也不会和O2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
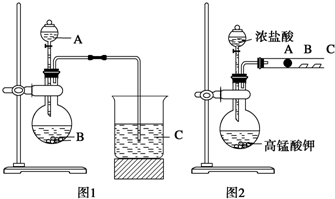
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
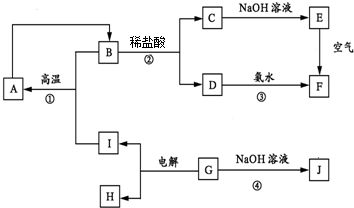
 ,E的化学式为Fe(OH)2.
,E的化学式为Fe(OH)2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com