
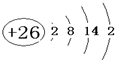 .A的一种晶体的晶胞如图1甲,乙图中
.A的一种晶体的晶胞如图1甲,乙图中 和
和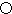 表示的是同种原子,即乙是8个甲无隙并置的结果,若按甲图中虚线方向切乙,得到图2的a~d,图中正确的是a.
表示的是同种原子,即乙是8个甲无隙并置的结果,若按甲图中虚线方向切乙,得到图2的a~d,图中正确的是a.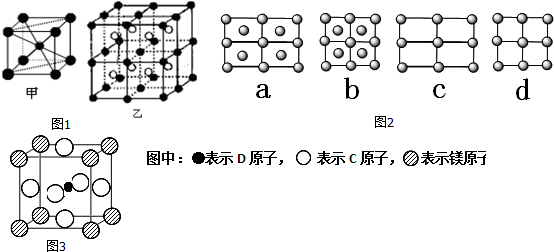
 . 据报道,只含镁、C和D三种元素的晶体竟然具有超导性.该晶体的结构(如图3示)可看作由镁原子和C原子在一起进行面心立方密堆积,该晶体的化学式为MgCNi3.晶体中每个
. 据报道,只含镁、C和D三种元素的晶体竟然具有超导性.该晶体的结构(如图3示)可看作由镁原子和C原子在一起进行面心立方密堆积,该晶体的化学式为MgCNi3.晶体中每个 原子周围距离最近的
原子周围距离最近的 原子有12个.
原子有12个.分析 A、B、C、D 四种元素位于周期表中前四周期,A的基态原子中有4个未成对电子,则这四个未成对电子应在d轨道上,所以A为Fe元素,B与A同周期,且原子核外未成对电子数最多,则B的价电子排布应为3d54S1,所以B是Ti元素,C位于周期表中第4行、第10列,则C为Ni元素,D的基态原子的最外层电子数是其电子层数的2倍,未成对电子数与电子层数相等,则D为C元素,据此答题.
解答 解:A、B、C、D 四种元素位于周期表中前四周期,A的基态原子中有4个未成对电子,则这四个未成对电子应在d轨道上,所以A为Fe元素,B与A同周期,且原子核外未成对电子数最多,则B的价电子排布应为3d54S1,所以B是Ti元素,C位于周期表中第4行、第10列,则C为Ni元素,D的基态原子的最外层电子数是其电子层数的2倍,未成对电子数与电子层数相等,则D为C元素,
(1)根据上面的分析可知,A为Fe元素,是26号元素,Fe的原子结构示意图是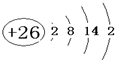 ,甲图虚线是沿面对角线的位置,切下之后可以得到一个矩形平面图,在矩形的中心有一个铁原子,而乙图有八个象甲一样的立方体堆积而成,若按甲虚线方向切乙,矩形,且矩形中心有一个原子,符合这一特征的是图a,
,甲图虚线是沿面对角线的位置,切下之后可以得到一个矩形平面图,在矩形的中心有一个铁原子,而乙图有八个象甲一样的立方体堆积而成,若按甲虚线方向切乙,矩形,且矩形中心有一个原子,符合这一特征的是图a,
故答案为: ;a;
;a;
(2)B是Ti元素,B原子的基态的外围电子排布式为3d54S1,与B同周期且基态原子最外层电子数与B相同的元素,可能位于周期表中的s区和ds区,
故答案为:3d54S1;s和ds;
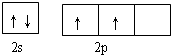
(3)D原子的外围电子排布图是 ,根据如图3示,该晶胞中含有碳原子数为1,含有Ni原子为$6×\frac{1}{2}$=3,镁原子数为$8×\frac{1}{8}$=1,所以该晶体的化学式为MgCNi3,晶体中每个镁原子周围距离最近的镍原子分布在晶胞的面心上,有12 个,
,根据如图3示,该晶胞中含有碳原子数为1,含有Ni原子为$6×\frac{1}{2}$=3,镁原子数为$8×\frac{1}{8}$=1,所以该晶体的化学式为MgCNi3,晶体中每个镁原子周围距离最近的镍原子分布在晶胞的面心上,有12 个,
故答案为: ;MgCNi3;
;MgCNi3;
(4)C为Ni元素,由于NiXO晶体晶胞结构为NaCl型,所以晶胞中两个Ni原子之间的最短距离为晶胞面对角线的$\frac{1}{2}$,由晶胞棱边长可求得晶胞面对角线为长为:$\sqrt{2}$×4.28×10-10m,所以晶胞中两个Ni原子之间的最短距离为$\frac{1}{2}$×$\sqrt{2}$×4.28×10-10m=3.03×10-10m,设晶体中Ni2﹢与Ni3﹢的最简整数比为x:y,根据NiXO中化合价代数和为零可知,$\frac{2x+3y}{x+y}$×0.88=2,由此解得x:y=8:3,
故答案为:3.03×10-10;8:3.
点评 本题主要考查了原子核外电子排布、元素周期表的结构、电子排布图、晶胞结构的计算等知识点,综合性较强,中等难度.


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
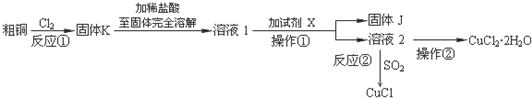
小学教材完全解读系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

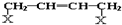
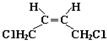

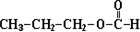 和
和 

 _
_查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 |
| HClO | HClO?ClO-+H+ | 2.95×10-8 |
| H2S | H2S?H++HS- HS-?H++S2- | K1=9.1×10-8 K2=1.1×10-12 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.31×10-7 K2=5.61×10-11 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
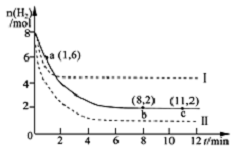 工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).将6molCO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化.下列说法正确的是( )
工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).将6molCO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化.下列说法正确的是( )| A. | 反应开始至a点时v(H2)=2mol•L-1•min-1 | |
| B. | 若曲线I对应的条件改变是升高温度,则该反应△H>0 | |
| C. | 曲线II对应的条件改变是降低压强 | |
| D. | 保持温度不变,若将平衡后的容器体积缩小至1L,重新达平衡时则2 mol•L-1<c(CH3OH)<8/3 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,28gN2含有的原子数为2NA | |
| B. | 1mol•L-1AlCl3溶液中含有的Cl-数为3NA | |
| C. | 标准情况下,2.24LCCl4含有的分子数NA | |
| D. | 常温常压下,22.4LCl2与足量铁充分反应,转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46g NO2和N2O4混合气体中含有原子数为3NA | |
| B. | 标准状况下22.4 L H2中含中子数为2NA | |
| C. | 1L 1mol/L醋酸溶液中离子总数为2NA | |
| D. | 1molFe与足量O2或Cl2反应均失去3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $\overrightarrow{②}$X $→_{③△}^{NaOH醇溶液}$乙
$\overrightarrow{②}$X $→_{③△}^{NaOH醇溶液}$乙 (注明反应条件).
(注明反应条件). ).写出同时符合①能发生银镜反应;②能与FeCl3溶液发生显色反应;③核磁共振氢谱图上产生4个吸收峰等要求的丙的同分异构体结构简式
).写出同时符合①能发生银镜反应;②能与FeCl3溶液发生显色反应;③核磁共振氢谱图上产生4个吸收峰等要求的丙的同分异构体结构简式 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2s | B. | 2 min | C. | 3s | D. | 3 min |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com