
用化学用语解释相关现象正确的是( )
A.BaSO4的水溶液导电性极弱:BaSO4 Ba2++SO42-
Ba2++SO42-
B.KHSO4在熔融状态下可导电:KHSO4=K++H++SO42-
C.常温下,0.1mol/L的HF溶液的pH>1:HF+H2O H3O++F-
H3O++F-
D.向KI-淀粉溶液中滴加稀硫酸,溶液变蓝色:4I-+O2+2H2O=2I2+4OH-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年新疆兵团二师华山中学高一期中化学卷(解析版) 题型:实验题
用Na2CO3·10H2O晶体,配制0.2 mol·L-1的Na2CO3溶液480 mL。
(1) 应称取Na2CO3·10H2O晶体的质量: 。
(2) 根据下列操 作对所配溶液的浓度产生的影响,完成下列要求:
作对所配溶液的浓度产生的影响,完成下列要求:
① Na2CO3·10H2O晶体失去了部分结晶水
② 用“左码右物”的称量方法称量晶体(使用游码)
③ 碳酸钠晶体不纯,其中混有氯化钠
④ 称量碳酸钠晶体时所用砝码生锈
⑤ 容量瓶未经干燥使用
⑥ 定容时俯视容量瓶刻度线
其中引起所配溶液浓度偏高的有 (填序号,下同),偏低的有 ,无影响的有 。
(3)下列操作中,容量瓶所不具备的功能有 。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上学期月考二化学卷(解析版) 题型:填空题
(12分)
Ⅰ.某温度下,0.1 mol/L的氢硫酸溶液中存在平衡:
①H2S(aq) H+(aq)+HS-(aq);②HS-(aq)
H+(aq)+HS-(aq);②HS-(aq) H+(aq)+S2-(aq);
H+(aq)+S2-(aq);
(1)氢硫酸溶液中存在的离子有 。(不完整不给分)
(2)若向H2S溶液中( )
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH增大
C.滴加新制氯水,平衡向左移动,溶液pH减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
Ⅱ.25℃时,部分物质的电离平衡常数如表所示:
化学式 | C | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH的电离平衡常数表达式 。
(2)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为 。
(3)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数 (填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是 。
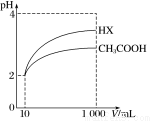
Ⅲ.在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH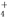 )=c(Cl-),则溶液显 性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
)=c(Cl-),则溶液显 性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:实验题
某实验小组欲用酸性KMnO4和H2C2O4反应通过测定单位时间内生成 CO2的量来探究影响反应速率的因素,设计实验方案如下:
实验序号 | A 溶液 | B 溶液 |
① | 20 mL 0.1 mol•L-1 H2C2O4 溶液 | 30 mL 0.01 mol•L-1 KMnO4 酸性溶液 |
② | 20 mL 0.2 mol•L-1 H2C2O4 溶液 | 30 mL 0.01 mol•L-1 KMnO4 酸性溶液 |

(1)检验上图装置气密性的最简便方法为:____________。
(2)H2C2O4溶液与酸性 KMnO4溶液反应的化学方程式为____________。
(3)该实验探究的是___________因素对化学反应速率的影响,相同时间内针筒中所得CO2的体积大小关系是___________(填实验序号)。
(4)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO4-)=________(若忽略溶液混合前后体积的变化)。
(5)小组同学发现反应速率总是如上右图所示,积极探究t1~t2时间内速率变快的主要原因,提出假设可能是:①__________、②_________、③K+对该反应有催化作用。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)(已知:2SO2+O2 2SO3),反应过程中的能量关系可用右图简单表示(图中的ΔH 表示生成1 mol产物的数据)。 下列说法正确的是( )
2SO3),反应过程中的能量关系可用右图简单表示(图中的ΔH 表示生成1 mol产物的数据)。 下列说法正确的是( )

A.S8的燃烧热 ΔH=-a kJ·mol-1
B.1 mol SO2和过量 O2反应可释放出 b kJ 的热量
C.已知1个S8分子中有8个S-S,S=O的键能为d kJ·mol-1,O=O的键能为e kJ·mol-1,则S8分子中S-S的键能为(2d-a-e) kJ·mol-1
D.若使用V2O5作催化剂,当SO2(g)转化生成1mol SO3(g)时,释放的热量小于b kJ
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.用CH3COOH 溶液做导电性实验,灯泡很暗, 能证明 CH3COOH 是弱电解质
B.将Ca(OH)2的饱和溶液加热, pH 和 Kw均增大
C.25℃时,1.0×10-3 mol·L-1盐酸的pH=3.0,1.0×10-8 mol·L-1盐酸的pH=8.0
D.向pH相同的氨水和氢氧化钠溶液中分别加入适量NH4Cl(s)后,两溶液的pH均减小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上期中化学卷(解析版) 题型:选择题
某50 mL溶液中可能含有H+、Na+、Mg2+、Al3+、SO42-、NH4+离子,当向该溶液中加入5 mol/L的NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积v(NaOH)变化关系如下图所示。
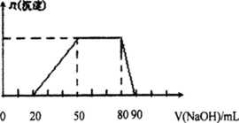
A.原溶液中一定含有的阳离子是H+、Mg2+、Al3+、SO42-
B. 原溶液中Al3+的浓度为lmol/L
C. 原溶液中NH4+的物质的量为0.4 mol
D. 当加入的NaOH溶液的体积为90mL时,反应后溶液中的离子只有Na+和SO42-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上期中化学卷(解析版) 题型:选择题
下列有关物质用途的描述不符合事实的是
A.氢氧化铝可用于治疗胃酸过多 B.过氧化钠可用作潜水艇供氧剂
C.铝制容器可以贮运浓硝酸 D.甲醛可用作食品防腐剂
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一上期中化学试卷(解析版) 题型:选择题
下列有关0.1mol/LKNO3溶液的叙述正确的是( )
A.在1L水中溶解10.1g KNO3,即可配制得0.1mol/L KNO3溶液
B.100mL该溶液中含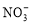 0.1mol
0.1mol
C.从1L该溶液中取出100mL,所取出的KNO3溶液的浓度为0.01mol/L
D.1L该溶液中含KNO3101g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com