
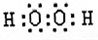 ,该物质为共价化合物,故答案为:H2O>NH3>SiH4;
,该物质为共价化合物,故答案为:H2O>NH3>SiH4;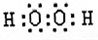 ;共价化合物;
;共价化合物;

科目:高中化学 来源: 题型:
| A、标准状况下,11.2L氯仿中含有的C-Cl键的数目为1.5NA |
| B、标准状况下,30g NO和16g O2混合所生成的气体分子数为NA |
| C、某温度时,1L pH=6的纯水中含有1.0×10-6NA个H+ |
| D、28g铁粉与足量Cl2反应时转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
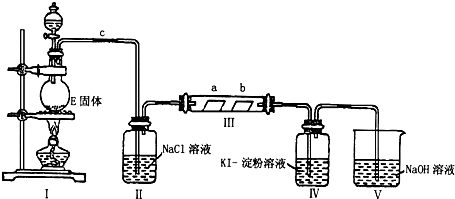
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始VA=VB=a L,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2N(g)+W(g),△H>0达到平衡时,v(A)=1.2aL,则下列说法错误的是( )
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始VA=VB=a L,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2N(g)+W(g),△H>0达到平衡时,v(A)=1.2aL,则下列说法错误的是( )| A、反应开始时,B容器中化学反应速率快 |
| B、A容器中X的转化率为40%,且比B中X的转化率小 |
| C、打开K一段时间,达到新平衡时,A的体积为2.6aL(两边通管中气体体积不计) |
| D、打开K达新平衡后,升高B容器温度,A容器体积会增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将稀释的硫酸转移至容量瓶后,未洗涤烧杯和玻璃棒 |
| B、将烧杯内的稀硫酸向容量瓶内转移时,因操作不当使部分稀硫酸溅出瓶外 |
| C、用胶头滴管向容量瓶中加水时凹液面高于容量瓶刻度线,此时立即用胶头滴管将瓶内多余液体吸出,使溶液凹液面与刻度线相切 |
| D、用胶头滴管向容量瓶中加入水时,仰视观察溶液凹液面与容量瓶刻度线相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com