
| A. | Na2O2和KMnO4分别制得1molO2转移的电子数均是4NA | |
| B. | 标准状况下,11.2L乙烯和环丙烷(C3H6)的混合气体中,共用电子对的数目为3NA | |
| C. | 若1L 0.2mol/L的FeCl3溶液完全水解形成胶体,则胶体微粒数为0.2NA | |
| D. | 用惰性电极电解1L0.lmol•L-1的食盐水,两极共收集到0.28mol的气体,则电路中转移电子数为0.34NA(不考虑气体的溶解) |
分析 A.Na2O2~O2~2mole-,KMnO4~O2~4mole-,据此进行分析;
B.利用极限的思想,分别求算11.2L的乙烯和环丙烷中含共用电子对数目,最终共用电子对数在两者之间,乙烯中含有4个碳氢键、1个碳碳键,乙烯分子中总共含有6个共用电子对,环丙烷中含有6个碳氢键、3个碳碳键,环丙烷分子中总共含有9个共用电子对,据此进行分析;
C.氢氧化铁胶粒为氢氧化铁的聚集体;
D.据2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH~2mole-,2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑~4mole-此进行计算.
解答 解:A.Na2O2~O2~2mole-,KMnO4~O2~4mole-,故制得1molO2,Na2O2转移的电子数2NA,KMnO4转移的电子数4NA,故A错误;
B.假设11.2L都是乙烯,则n(C2H4)=$\frac{11.2L}{22.4L/mol}$=0.5mol,1mol乙烯分子中含有6mol共用电子对,则0.5mol乙烯分子中含有3mol共用电子对,假设11.2L都是环丙烷,则n(C3H6)=$\frac{11.2L}{22.4L/mol}$=0.5mol,1mol环丙烷分子中含有9mol共用电子对,则0.5mol环丙烷分子中含有4.5mol共用电子对,故最终共用电子对数在3mol~4.5mol之间,即共用电子对数目为在3NA~4.5NA之间,故B错误;
C.若1L 0.2mol•L-1的FeCl3溶液完全水解形成胶体,由于氢氧化铁胶粒为氢氧化铁的聚集体,则胶体中微粒数小于0.2NA,故C错误;
D.电解1 L 0.1 mol•L-1的食盐水,2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH~2mole-,则 0.1mol氯离子全部反应生成氢气和氯气各 0.05 mol,转移电子数目为 0.1 NA,两极共收集到0.28 mol的气体,说明氯离子反应完全,后期是电解水,2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑~4mole-,生成氢气 0.12 mol和氧气 0.06 mol,转移电子数 0.24 NA,两个过程共转移电子0.34 NA,故D正确,
故选D.
点评 本题考查阿伏加德罗常数的计算与判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,C为难点、易错点,注意氢氧化铁胶粒为氢氧化铁的聚集体,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
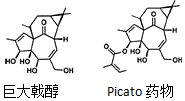 2016 年化学领域重要成果之一是丹麦制药公司LEO Pharma与美国斯克里普斯研究所(The Scripps Research Institute)的Phil S.Baran课题组合作,成功地将合成巨大戟醇(一个分子中含有20个碳原子)的步骤由37步缩短至14步.巨大戟醇是合成治疗日光性角化病药物(Picato)的原料.下列说法错误的是( )
2016 年化学领域重要成果之一是丹麦制药公司LEO Pharma与美国斯克里普斯研究所(The Scripps Research Institute)的Phil S.Baran课题组合作,成功地将合成巨大戟醇(一个分子中含有20个碳原子)的步骤由37步缩短至14步.巨大戟醇是合成治疗日光性角化病药物(Picato)的原料.下列说法错误的是( )| A. | 由巨大戟醇制备Picato药物的另一种反应物是(CH3)2C=CHCOOH | |
| B. | 巨大戟醇能发生取代反应、氧化反应、加成反应 | |
| C. | 巨大戟醇和Picato药物都不属于芳香族化合物 | |
| D. | 0.1mol巨大戟醇完全燃烧消耗2.45molO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作或现象 | 结论 |
| A | 向含有NaOH的Mg(OH)2悬浊液中滴加CoCl2溶液,产生粉色沉淀 | KSP[Co(OH)2]<KSP[Mg(OH)2] |
| B | 将铁粉和铜粉分别和硫粉混合加热,分别生成FeS、Cu2S | 还原性:Fe>Cu |
| C | 在透明溶液中通入CO2,产生白色胶状物质 | 原溶液含有SiO32- |
| D | 控制其它条件相同,在过氧化氢中分别加入等量的氯化铁和氯化铜做催化剂,加入氯化铁的产生气泡速率更快 | 其它条件相同时,Fe3+对过氧化氢分解的催化作用强于Cu2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 1mol苹果酸与足量金属Na反应生成生成lmolH2 | |
| B. | 1mol苹果酸可与3molNaOH发生中和反应 | |
| C. | 苹果酸中能发生酯化反应的官能团有2种 | |
| D. |  与苹果酸互为同分异构体 与苹果酸互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
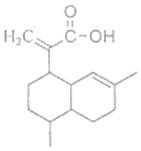
| A. | X为烃的含氧衍生物 | |
| B. | X最多可以和3mol H2发生加成反应 | |
| C. | X只能发生取代反应和加成反应 | |
| D. | X可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且褪色原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 聚氯乙烯塑料广泛应用于塑料薄膜、食品包装袋等 | |
| C. | 高铁车厢材料大部分采用铝合金,因为铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 氢氧燃料电池、硅太阳能电池都利用了原电池原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X的最高价含氧酸为强酸,则X的氢化物溶于水一定显酸性 | |
| B. | 若Y的最高正价为+m,则X的最高正价一定为+m | |
| C. | 若X元素形成的单质是X2,则Y形成的单质一定是Y2 | |
| D. | 若X(OH)n为强碱,则Y(OH)n也一定为强碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com