
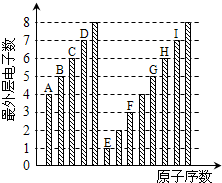
| A、原子半径:A<B<C<D |
| B、E和C元素形成的化合物中只可能存在离子键 |
| C、气态氢化物稳定性:I>D>H>G |
| D、E、F和H三种元素相应的最高价氧化物对应水化物之间两两会发生反应 |


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
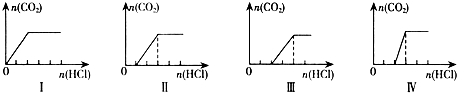
| 溶质的成份 | 对应的图象 | 原溶液中离子浓度关系 | |
| A | NaHCO3 | Ⅰ | c(Na+)=c(HCO3-) |
| B | NaHCO3、Na2CO3 | Ⅱ | c(CO32-)<c(HCO3-) |
| C | NaOH、Na2CO3 | Ⅲ | c(OH-)>c(CO32-) |
| D | Na2CO3 | Ⅳ | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| A、Ⅰ | B、Ⅱ | C、Ⅲ | D、Ⅳ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 投料比[n(H2)/n(CO2)] | 500K | 600K | 700K | 800K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
查看答案和解析>>
科目:高中化学 来源: 题型:
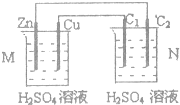
| A、C1上发生还原反应 |
| B、M装置中SO2-4移向Cu电极 |
| C、工作一段时间后装置M中溶液PH变大,装置N中溶液PH变小 |
| D、Cu电极与C2电极上的电极反应不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 性质 |
| A | 一种核素的原子核内不含中子 |
| B | 原子核外电子有6种不同运动状态 |
| C | 最高价氧化物的水化物与其氢化物可发生非氧化还原反应 |
| D | 单质之一为淡蓝色气体,可阻挡对人体有害的紫外线 |
| E | 在地壳中的含量位居第三 |
| F | 周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍 |
| G | 该元素的一种氧化物M可用作油漆颜料,与E的单质反应可应用于焊接钢轨 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| B、1 mol Na202固体中含离子总数为4NA |
| C、标准状况下,11.2L苯中含有分子的数目为0.5NA |
| D、在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度 |
| B、加入适量的水 |
| C、加入少量CuSO4溶液 |
| D、加入浓度较大的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
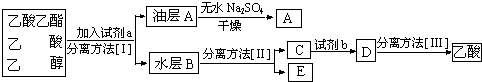
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com