
【题目】一定条件下,在恒容密闭容器中进行反应3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g)不能表示上述反应达到化学平衡状态的是( )
Si3N4(s)+12HCl(g)不能表示上述反应达到化学平衡状态的是( )
A.v逆(N2)=3v正(H2)
B.N2和HCl物质的量之比保持不变
C.混合气体密度保持不变
D.每消耗3molSiCl4(g)的同时消耗1molSi3N4(s)
科目:高中化学 来源: 题型:
【题目】关于室温下下列溶液的说法不正确的是( )
编号 | ① | ② | ③ | ④ |
溶液 | 氨水 | 氢氧化钠溶液 | 盐酸 | 醋酸溶液 |
pH | 11 | 11 | 3 | 3 |
A. 水的电离程度:①=②=③=④
B. 分别加水稀释10倍,溶液的pH:①>②>③>④
C. ①③两溶液等体积混合:c(Cl-)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D. V1 L溶液②与V2 L溶液③混合,若V1∶V2=9∶11,则混合溶液pH=4(忽略溶液体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑索金是一种爆炸力极强的烈性炸药,比TNT猛烈1.5倍。可用浓硝酸硝解乌洛托品得到黑索金,同时生成硝酸铵和甲醛(HCHO)。下列说法不正确的是( )
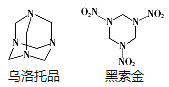
A.乌洛托品的分子式为C6H12N4
B.乌洛托品分子结构中含有3个六元环
C.乌洛托品的一氯代物只有一种
D.乌洛托品得到黑索金反应中乌洛托品与硝酸的物质的量之比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生的主要反应为:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g)。已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g)。已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K=________,该反应是_________反应(填“放热”或“吸热”)。
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe2O3、CO各4.0 mol,反应经过20min后达到平衡。求该时间范围内反应的平均反应速率v(CO)=__________、CO的平衡转化率=__________。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是________
A.降低反应温度 B.增加Fe2O3的量 C.加入合适的催化剂 D.移出部分CO2 E.减小容器的容积
(4)在1L的密闭容器中,1150℃条件,下列达平衡状态的是__________。
A | B | C | D | |
n(Fe2O3) | 0.350 | 0.027 | 0.080 | 0.080 |
n(CO) | 0.010 | 0.010 | 0.010 | 0.050 |
n(Fe) | 0.100 | 0.064 | 0.080 | 0.080 |
n(CO2) | 0.035 | 0.088 | 0.037 | 0.050 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸甲酯催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为: CH3COOCH3(l) +C6H13OH (l) ![]() CH3COOC6H13(l) +CH3OH(l)
CH3COOC6H13(l) +CH3OH(l)
反应开始时,己醇和乙酸甲酯按物质的量之比 1:1 投料,测得 348 K、343 K 两个温度 下乙酸甲酯转化率(α)随时间(t)的变化关系如下图所示:
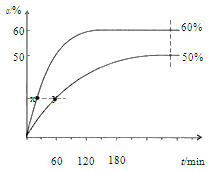
下列说法不正确的是
A.该醇解反应的ΔH > 0
B.反应速率:v(x)> v(y)
C.343K时,以物质的量分数表示的化学平衡常数 Kx=2.25
D.348K时,初始投料![]() 分别按 1:1和2:1进行,Kx 相同
分别按 1:1和2:1进行,Kx 相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质能满足如图所示转化关系的是(图中箭头表示进一步转化)

a | b | c | d | |
① | Si | SiO2 | H2SiO3 | Na2SiO3 |
② | Al | AlCl3 | NaAlO2 | Al(OH)3 |
③ | Cu | CuO | Cu(OH)2 | CuSO4 |
④ | Fe2O3 | FeCl3 | FeCl2 | Fe |
A. ①② B. ②③ C. ③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在某200mL的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。(设硝酸只被还原为NO气体,Fe的相对原子质量为56)。下列有关分析错误的是
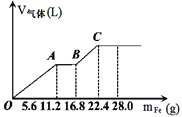
A.原混合酸中NO3-的物质的量为0.2mol
B.原混合酸中H2SO4物质的量浓度为2mol/L
C.OA段与BC段反应中电子转移的物质的量之比为2:1
D.取20mL原混合酸加水稀释至1L后溶液的pH=1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.含0.1molFeI2的溶液中通入0.125molCl2:2Fe2++8I-+5Cl2=2Fe3++4I2+10Cl-
B.浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+![]() Fe3++3NO2↑+3H2O
Fe3++3NO2↑+3H2O
C.Cu溶于稀HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O
D.氢氧化铁中加入过量氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)全固态锂离子电池的结构如图所示,放电时电池反应为 2Li+MgH2=Mg+2LiH。放电时,X 极作_________极。充电时,Y 极反应式为___________。
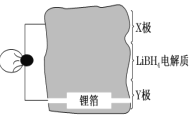
(2)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子)。
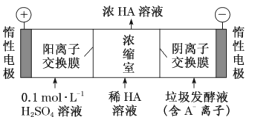
①阳极的电极反应式为 ________________
②简述浓缩室中得到浓乳酸的原理:________________
③电解过程中,采取一定的措施可控制阳极室的 pH 约为 6~8,此时进入浓缩室的OH-可忽略不计。400 mL 10 gL 1 乳酸溶液通电一段时间后,浓度上升为 145 gL 1 (溶液体积变化忽略不计),阴极上产生的 H2 在标准状况下的体积约为_____________L。(乳酸的摩尔质量为90 gmol-1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com