
【题目】某溶液中可能含有H+、NH![]() 、Mg2+、Al3+、CO
、Mg2+、Al3+、CO![]() 、SO
、SO![]() 中的几种。
中的几种。
①若加入锌粒,最终产生无色无味的气体;
②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示,则下列说法正确的是( )

A. 溶液中的阳离子只有H+、Mg2+、Al3+
B. 溶液中n(NH![]() )=0.2 mol
)=0.2 mol
C. 溶液中一定不含CO![]() ,可能含有SO
,可能含有SO![]()
D. n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
【答案】B
【解析】①若加入锌粒,最终产生无色无味的气体,气体是氢气,溶液显酸性,则一定不存在碳酸根离子;②加入NaOH溶液,产生白色沉淀,根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续加入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+,由于溶液中还必须存在阴离子,所以一定还有SO42-;由图象可知,第一阶段为氢离子与氢氧化钠反应,消耗氢氧化钠为0.1mol,则n(H+)=0.1mol;第三阶段为铵根离子与氢氧化钠反应,消耗氢氧化钠为0.7mol-0.5mol=0.2mol,则n(NH4+)=0.2mol;最后阶段为氢氧化钠溶解氢氧化铝,消耗氢氧化钠0.8mol-0.7mol=0.1mol,则n[Al(OH)3]=0.1mol,根据铝元素守恒可知n(Al3+)=0.1mol;第二阶段为氢氧化钠沉淀镁离子、铝离子,共消耗氢氧化钠为0.5mol-0.1mol=0.4mol,则n(Mg2+)=(0.4mol-0.1mol×3)÷2=0.05mol,A.由上述分析可知,溶液中的阳离子只有H+、Mg2+、Al3+、NH4+,A错误;B.由上述分析可知,溶液中n(NH4+)=0.2mol,B正确;C.由上述分析可知,溶液中一定不含CO32-,一定含有SO42-,C错误;D.由上述分析可知,溶液中n(H+)∶n(Al3+)∶n(Mg2+)=2∶2∶1,D错误,答案选B。


科目:高中化学 来源: 题型:
【题目】“白色污染”的主要危害是:( )
①破坏土壤结构 ②降低土壤肥效 ③污染地下水 ④危及海洋生物的生存
A. ①② B. ②③ C. ①②③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素X 的气态氢化物的化学式为XH3 ,则X 的最高价氧化物的水化物的化学式为( )
A.H2XO3 B.HXO3 C.HXO D.H2XO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程中,原物质分子内共价键被破坏,同时有离子键形成的是
A.盐酸和NaOH溶液混合 B.氯化氢溶于水
C.溴化氢气体与氨气相遇反应 D.锌和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 物质发生化学变化都伴随着能量变化
B. 任何反应中的能量变化都表现为热量变化
C. 伴有能量变化的物质变化都是化学变化
D. 放热反应都不需要加热就能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗硅提纯常见方法之一是先将粗硅与HCl反应制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g)。在2L密闭容器中,不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图。下列判断合理的是
Si(s)+3HCl(g)。在2L密闭容器中,不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图。下列判断合理的是
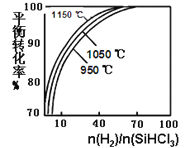
A. X是H2
B. 1150℃反应的平衡常数大于950℃时反应的平衡常数
C. 减小Si(s)的量,有利于提高SiHCl3的转化率
D. 工业上可采用增大压强的方法提高产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作不当的是( )
A. 用稀硫酸和锌粒制取H2时,加几滴CuSO4溶液以加快反应速率
B. 利用酸性高锰酸钾溶液除甲烷中的少量乙烯
C. 用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有Na+
D. 向溴水中加入苯,可以萃取溴水中的溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属钛、铬、铁、镍、铜等金属及其化合物在工业上有用途。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①Ti的基态原子价电子排布式为_________。
②Fe元素在周期表中的位置是_________。
(2)制备 CrO2Cl2的反应为 K2Cr2O7+3CCl4=2KCl+2 CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由小到大的顺序________。(用元素符号表示)
②COCl2分子中所有原子均满足8电子构型,COCl2分子中π键和σ键的个数比为____,中心原子的杂化方式为_______。
(3)NiO、FeO的晶体结构均与NaCl的晶体结构相似,其中Ni2+和Fe2+的离子半径分別为6.9×10-2nm和7.8×10-2nm。则熔点:FeO_____(填“>”“<”或“=” )NiO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在中国已实现了产业化.该合金的晶胞结构如图所示。

①该晶体的化学式为__________。
②已知该晶胞的摩尔质量为Mg/mol,密度为dg/cm3。设NA为阿伏加徳罗常数的值,则该晶胞的体积是_______(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较温定。
已知:a=511pm,c=397pm;标准状况下氢气的密度为8. 98×10-5g/cm3;
![]() 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为________。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com