
下列有关叙述正确的是( )
A.因为C和Si是同主族元素,故CO2和SiO2形成的晶体相同
B.在晶体中有阳离子就一定有阴离子
C.由于水分子间可以形成氢键故水分子的稳定性很强
D.在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016届海南省高三考前模拟理综化学试卷(解析版) 题型:选择题
除去括号中的杂质不正确的是( )
A.乙烯(SO2、H2O):碱石灰,洗气
B.乙烷(乙烯):酸性 KMnO4,洗气
C.炭粉(MnO2):热的浓盐酸,过滤
D.Cl2(HCl):饱和食盐水,洗气
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二6月月考化学试卷(解析版) 题型:选择题
某溶液中滴加一定量的BaCl2溶液产生白色沉淀,再加入硝酸,沉淀不溶解,这种溶液中
A.一定含SO42- B.一定含Ag+
C.可能含SO42- D.可能含CO32-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古赤峰二中高二6月月考化学试卷(解析版) 题型:选择题
0.96g Mg跟含6.3g HNO3的稀溶液恰好反应完全,则HNO3的还原产物的摩尔质量可能是( )
A.30 g•mol﹣1或46 g•mol﹣1 B.44 g•mol﹣1或80 g•mol﹣1
C.28 g•mol﹣1 D.46 g•mol﹣1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古赤峰二中高二6月月考化学试卷(解析版) 题型:选择题
下列表述和方程式书写都正确的是( )
A.表示乙醇燃烧热的热化学方程式(△H的绝对值正确):
C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=﹣1367.0kJ•mol﹣1
B.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:
Al3++2SO42-+2Ba2++4OH-= AlO2-+2BaSO4↓+2H2O
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
D.用硫酸酸化的橙色的重铬酸钾(K2Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,可以用于检测是否酒后驾驶:2Cr2O72﹣+3C2H5OH+16H+→4Cr3++3CH3COOH+11H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁葫芦岛一中等五校高二6月联考化学卷(解析版) 题型:简答题
【化学-选修2:化学与技术】印尼火山喷发不仅带来壮观的美景,还给附近的居民带来物质财富,有许多居民冒着生命危险在底部的火山口收集纯硫磺块来赚取丰厚收入。硫磺可用于生产化工原料硫酸。某工厂用如图所示的工艺流程生产硫酸:
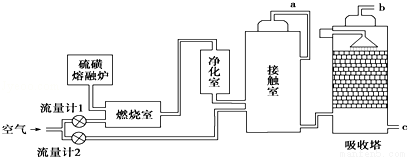
请回答下列问题:
(1)为充分利用反应放出的热量,接触室中应安装 (填设备名称).吸收塔中填充有许多瓷管,其作用是 。
(2)为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%,为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为 .假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 (空气中氧气的体积分数按0.2计),该尾气的处理方法是  。
。
(3)与以硫铁矿为原料的生产工艺相比,该工艺的特点是 。
A.耗氧量减少
B.二氧化硫的转化率提高
C.产生的废渣减少
D.不需要使用催化剂
(4)硫酸的用途非常广,可应用于下列哪些方面 。
A.橡胶的硫化
B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产
D.过磷酸钙的制备
(5)矿物燃料的燃烧是产生大气中SO2的主要原因之一.在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁葫芦岛一中等五校高二6月联考化学卷(解析版) 题型:选择题
固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s) NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g) H2(g)+I2(g)达到平衡时,c(H2)=0.5mol•L﹣1,c(HI)=3mol•L﹣1,则此温度下反应①的平衡常数为
H2(g)+I2(g)达到平衡时,c(H2)=0.5mol•L﹣1,c(HI)=3mol•L﹣1,则此温度下反应①的平衡常数为
A.12 B.16 C.20 D.25
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北沙市高一下第六次半月考化学卷(解析版) 题型:实验题
针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
活动一:查阅资料
NaNO2有毒,具有氧化性和还原性,NaNO2溶液显碱性,肉类在放置过程中,NaNO3逐渐转化为NaNO2,国家规定肉制品中NaNO2含量不能超过30 mg/kg。
活动二:鉴别NaNO2与食盐
(1)NaNO2与食盐的外观相似,易被当成食盐误用,分析以下两种鉴别方法:
① 能否各取少许固体用舌头品尝?_____。(选填“能”或“不能”)
② 用稀硫酸、淀粉和KI溶液鉴别,溶液变蓝的是NaNO2具有___性。
活动三:探究NaNO3与NaNO2的相互转化
(2)制取NaNO2与NaNO3混合溶液的装置如图所示。

已知:2NO2+2NaOH=NaNO2+NaNO3+H2O。
① 写出装置I中发生反应的化学方程式___________________________________。
② 水_______(选填“能"或“不能”)作为装置II中的试剂,理由是_________________。
③ 装置III中反应完全后,接下来的操作是_________________________________。
(3)将NaNO2与NaNO3混合溶液露置于空气,隔夜后,测得溶液的pH减小,则溶液中NaNO2的含量_______(选填“增多”、“减少"或“不变”),原因可能是______________(用化学方程式解释)。
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三三模理综化学试卷(解析版) 题型:实验题
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
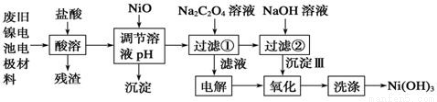
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4 >NiC2O4。 H2O > NiC2O4
H2O > NiC2O4 2H2O。
2H2O。
③ Ksp[Ni(OH)2]: 5.0×10-16 , Ksp(NiC2O4): 4.0×10-10。
认真研读题给信息,回答下列问题:
(1)酸溶后所留残渣的主要成份 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式 ,该反应的平衡常数为 。
(5)电解过程中阴极反应式为: ,沉淀Ⅲ可被电解所得产物之一氧化,写出氧化反应的离子方程式: 。
(6)铁镍蓄电池,放电时总反应:Fe+Ni2O3+3H2O =Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是 。
A.电池的电解液为碱性溶液,电池的正极为Ni2O3,负极为Fe
B.电池充电时,阴极附近溶液的pH降低
C.电池放电时,负极反应为Fe+20H一一2e一
 Fe(OH)2
Fe(OH)2
D.电池充电时,阳极反应为2Ni(OH)2+20H一一2e一 Ni2O3+3 H2O
Ni2O3+3 H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com