
【题目】短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素。

请用化学用语回答下列问题:
(1)E元素在周期表中的位置: 。
(2)A、D、E元素简单离子半径由大到小的顺序为 > > (填微粒符号)。
(3)F与D同主族且相邻,二者气态氢化物稳定性的大小关系为 > (填微粒符号)。
(4)用高能射线照射含有10电子的D元素氢化物分子时,一个分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出阳离子的电子式: ,该阳离子中存在的化学键有 。
(5)由C、E两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里C、E两种原子最外层均达到8个电子的稳定结构。甲遇水蒸气可形成一种常见的漂白性物质。则甲的结构式为 。
【答案】(1)第3周期ⅦA族(1分) (2)Cl-(1分) O2-(1分)Al3+(1分)
(3)H2O (1分) H2S (1分) (4)![]() (2分) 共价键(2分)
(2分) 共价键(2分)
(5)NCl3的结构式(略)(2分)
【解析】试题分析:短周期主族元素中,A为地壳中含量最高的金属元素,则A为Al元素,由元素在周期表中的相对位置,可知B为碳元素、C为N元素、D为O元素、E为Cl。
(1)E为Cl元素,原子核外有3个电子层,最外层电子数为7,处于周期表中第三周期第ⅦA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多离子半径越大,故离子半径:Cl->O2->Al3+;
(3)F与D同主族且相邻,则F为S元素,同主族自上而下非金属性减弱,氢化物稳定性与元素非金属性一致,故氢化物稳定性H2O>H2S;
(4)用高能射线照射含有10电子的D元素氢化物分子时,一个分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,该阳离子的化学式为H2O+,该阳离子的电子式为![]() ,其中存在的化学键有共价键;
,其中存在的化学键有共价键;
(5)由C、E两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里C、E两种原子最外层均达到8个电子的稳定结构。甲遇水蒸气可形成一种常见的漂白性物质,该物质是次氯酸,因此甲的化学式为NCl3,根据氨气的结构式可判断甲的结构式为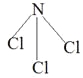 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与应用相对应的是
A.SO2具有氧化性,可用于漂白纸浆
B.氢氟酸具有酸性,可用于雕刻玻璃
C.二氧化氯具有还原性,可用于自来水的杀菌消毒
D.NH3具有还原性,可用NH3与灼热CuO作用制取少量N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。

完成下列填空:
(1)半水煤气含有少量硫化氢。将半水煤气样品通入____溶液中(填写试剂名称),出现_______,可以证明有硫化氢存在。
(2)半水煤气在铜催化下实现CO变换:CO+H2O![]() CO2+H2
CO2+H2
若半水煤气中V(H2):V(CO):V(N2)=38:28:22,经CO变换后的气体中:V(H2):V(N2)=____________。
(3)碱液吸收法是脱除二氧化碳的方法之一。已知:
Na2CO3 | K2CO3 | |
20℃碱液最高浓度(mol/L) | 2.0 | 8.0 |
碱的价格(元/kg) | 1.25 | 9.80 |
若选择Na2CO3碱液作吸收液,其优点是__________;缺点是____________。如果选择K2CO3碱液作吸收液,用什么方法可以降低成本?
___________________________________________
写出这种方法涉及的化学反应方程式。_______________________
(4)以下是测定半水煤气中H2以及CO的体积分数的实验方案。
取一定体积(标准状况)的半水煤气,经过下列实验步骤测定其中H2以及CO的体积分数。
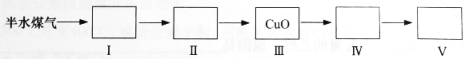
①选用合适的无机试剂分别填入Ⅰ、Ⅰ、Ⅳ、Ⅴ方框中。
②该实验方案中,步骤Ⅰ、Ⅱ的目的是: 。
③该实验方案中,步骤________(选填“Ⅳ”或“Ⅴ”)可以确定半水煤气中H2的体积分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)14g CO 在氧气中燃烧生成 CO2,放出33.6kJ 热量,写出 CO 燃烧热的化学方程式 。
(2)已知500mL 0.2mol/L的硫酸与含11.2g氢氧化钾的稀溶液反应,放出热量11.46kJ,表示该反应中和热的化学方程式为: 。
(3)下列物质中均含有极性共价键的是 。
A. NH3; CO2; NH4Cl; NaOH;
B. H2O ; NH4Cl ; H2SO4 ; H2O2 ;
C. CaCl2 ; CO2 ; Na2O2 ; Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
![]()
(1)为尽量少引入杂质,试剂①应选用___(填标号)。
A.HCl溶液 B.H2SO4溶液 C.氨水 D.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为________。
(3)沉淀B的化学式为________;将少量明矾溶于水,溶液呈弱酸性,其原因是__________。
(4)已知:Kw=1.0×10-14,Al(OH)3![]() AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出CO2和Na2O2反应的化学方程式:_______________。
(2)某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗?________,简要说明理由:__________________________。
(3)该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(图中铁架台等装置已略去)。

装置中B的作用是__________________,D的作用是_______________。
(4)为确认反应产物,该同学设计了以下实验步骤,你认为应进行的操作按顺序排列是(选填序号)________。
A.用带火星的细木条靠近干燥管口a,观察细木条是否着火燃烧
B.将C装置中反应后的固体物质溶于适量水配成溶液
C.在配成的溶液中加入用硝酸酸化的硝酸钡溶液,观察是否有沉淀生成
D.在配成的溶液中先加入盐酸,再加入氯化钡溶液,观察是否有气泡或沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示装置,总反应的离子方程式为_________________________。
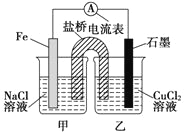
(2)质量相等的两电极反应后质量相差12 g,则导线中通过了____________mol 电子。
(3)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式_____________________,这是由于NH4Cl溶液显__________ (填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是
A. SO2、SiO2、CO均为酸性氧化物
B. 稀豆浆、硅酸、氯化铁溶液均为胶体
C. 烧碱、冰醋酸、四氯化碳均为电解质
D. 氯水、水玻璃、氨水均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组的同学利用如图所示装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。
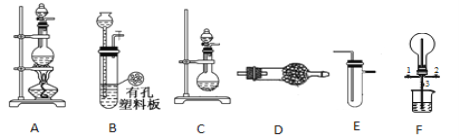
请回答:
(1)根据上述实验装置,为制备干燥NH3,可选用的发生、净化装置为 接 。其中发生装置中可以选用的药品为 (填选项字母)
a.碱石灰和浓氨水 b.浓H2SO4和浓氨水 c.碱石灰和氯化铵 d.生石灰和氯化铵
(2)根据上述实验装置,用MnO2和浓盐酸制备纯净、干燥的Cl2,可选用的发生、净化装置为 接E、接E,第一个E装置的药品是 。
(3)利用装置F可探究Cl2与 NH3 的反应。
已知Cl2与 NH3可发生反应:3Cl2+2NH3=N2+6HCl
①实验时打开开关1、3,关闭2,先向烧瓶中通入 (气体名称),然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。
②实验一段时间后烧瓶内出现的现象为: 。
③装置F中烧杯内发生反应的离子方程式为 。
④请设计一个实验方案(操作过程、实验现象)鉴定烧瓶内最终产物的阳离子,其方案为 。
(4)一定条件下,Cl2 与CH4在装置F中发生反应,其有机产物有 。(填化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com