
分析 同种物质由固体到液体,由液体到气体过程属于吸热过程;常见的反应中:大多数化合反应、物质的燃烧、酸碱中和、铝热反应、金属与酸的置换反应属于放热反应;
大多数分解反应、氯化铵晶体与氢氧化钡的反应、碳与二氧化碳的反应等属于吸热反应;
熵是用来描述的是体系的混乱度,混乱度越大熵值越大,质溶解过程、气体扩散过程、同种物质由固体到液体,由液体到气体过程、反应中生成气体、反应中气体系数增大的反应都是熵增大的过程,据此解答.
解答 解:(1)Fe(s)→Fe(g),物质由固体到气体变化,需要吸收热量;体现混乱度增大,属于熵增大的过程;
答:Fe(s)→Fe(g),吸热,熵增大;
(2)H2(g)+$\frac{1}{2}$O2(g)═H2O(l),氢气燃烧属于放热反应;反应中气体系数减小,属于熵减小反应;
答:H2(g)+$\frac{1}{2}$O2(g)═H2O(l),放热;熵减小;
(3)4Al(s)+3O2(g)═2Al2O3(s)是化合反应,属于放热反应;反应中气体系数减小,属于熵减小的反应;
答:4Al(s)+3O2(g)═2Al2O3(s),放热;熵减小;
(4)Na0H(s)═Na+(aq)+OH-(aq),固体溶解属于吸热过程;混乱度增大,属于熵增大的过程;
答:Na0H(s)═Na+(aq)+OH-(aq),吸热;熵增大.
点评 本题考查了变化过程中焓变、熵变的分析判断,明确常见的放热反应、吸热反应,熵增大、熵减小的过程是解题关键,题目难度不大.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:解答题
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
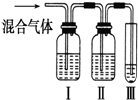 为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯,将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应.乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量有还原性的杂质气体,由此他提出必须先把杂质气体除去,再与溴水反应.
为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯,将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应.乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量有还原性的杂质气体,由此他提出必须先把杂质气体除去,再与溴水反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氧化氢溶掖的试管内加入肝或沙子.在这个实验中,试管A放氧相对缓慢,试管C和D不放氧.请问答下列问题:
氧化氢溶掖的试管内加入肝或沙子.在这个实验中,试管A放氧相对缓慢,试管C和D不放氧.请问答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤①② | B. | ①②⑤③④ | C. | ⑤④③②① | D. | ③④⑤②① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com