
| A. | ①②③④⑤ | B. | ②③④⑤⑥ | C. | ②③⑤⑥⑦ | D. | ①②⑤⑥⑦ |
分析 ①溶质的物质的量相同,消耗的盐酸的物质的量也相同;
②从电离平衡移动的角度分析;
③正反应吸热,温度升高,平衡向正反应方向移动;
④加热氯化镁溶液,促进镁离子的水解;
⑤醋酸钠溶液中醋酸根离子是弱酸阴离子,醋酸根离子水解结合水电离出的氢离子,促进水的电离平衡正向进行,氢氧根离子浓度增大;
⑥根据影响平衡移动的因素:减小生成物浓度,平衡正向移动;
⑦由于AgCl与AgI分子组成形式相同,故Ksp越大,溶解度越大,溶解度大的能转化为溶解度小.
解答 解:①因O.OL×0.1moL/L=0.1L×0.01moL/L,则溶质的物质的量相同,消耗的盐酸的物质的量也相同,故①错误;
②醋酸电离产生醋酸根离子,加入醋酸钠,醋酸根离子浓度变大,则平衡向逆向移动,故②正确;
③正反应吸热,温度升高,平衡向正反应方向移动,c(Z)增大,故③正确;
④加热氯化镁溶液,促进镁离子的水解,最终得到氢氧化镁,故④错误;
⑤碳酸钠为强碱弱酸盐,水解呈碱性,可使酚酞试液变红,故⑤正确;
⑥碳酸钙溶液中通入二氧化碳,可生成碳酸氢钙,平衡向溶解的方向移动,故⑥正确;
⑦碘化银的溶度积小于氯化银,则在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀,故⑦正确.
故选C.
点评 本题是高考中的常见考点,属于中等难度试题的考查,试题综合性强,侧重对学生基础知识的巩固和训练,主要是考查学生对四种平衡状态以及外界条件对平衡状态影响的了解程度,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力,有助于提升学生的学科素养.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
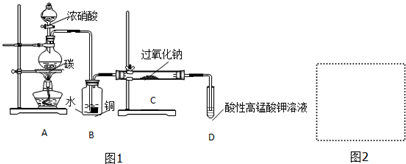

| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ④⑤⑥⑦ | C. | ②⑥ | D. | ①②③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的红色石蕊试纸检验某种气体是否是NH3 | |
| B. | 某种有色溶液可使淀粉-KI试纸变蓝色,则该溶液中可能含有Fe3+ | |
| C. | 用玻璃棒蘸取溶液点在用蒸馏水湿润过的pH试纸上可测量该溶液的pH | |
| D. | 将湿润的蓝色石蕊试纸片粘在玻璃棒上置于氯气中,试纸先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.10 mol•L-1AgNO3溶液 | B. | 0.10 mol•L-1ZnSO4溶液 | ||
| C. | 0.20 mol•L-1CuCl2溶液 | D. | 0.20 mol•L-1Mg(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2gCH3OH含有的化学键数为0.4NA | |
| B. | 0.1molFeCl3水解制得的Fe(OH)3胶体中胶粒数是0.1NA | |
| C. | 标准状况下,2.24LCl2溶于足量水,转移的电子数为0.1NA | |
| D. | 0.2gD216O中含有的质子数、中子数和电子数均为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com