
����Ŀ������˵����ȷ���ǣ� ��
A.H2(g)+I2(g)![]() 2HI(g)�������������䣬��С��Ӧ������������淴Ӧ���ʲ���
2HI(g)�������������䣬��С��Ӧ������������淴Ӧ���ʲ���
B.C(s)+H2O(g)![]() H2(g)+CO(g)��̼���������ٸı�˵����Ӧ�Ѵ�ƽ��
H2(g)+CO(g)��̼���������ٸı�˵����Ӧ�Ѵ�ƽ��
C.��ѹǿ������ʱ��仯��˵����Ӧ2A(��)+B(g)![]() 2C(��)�Ѵ�ƽ�⣬��A��C����ͬʱ������
2C(��)�Ѵ�ƽ�⣬��A��C����ͬʱ������
D.��ѹ�����·�����ӦN2(g)+3H2(g)![]() 2NH3(g)��������ѹǿ���ٸı�ʱ����Ӧ�ﵽƽ��״̬
2NH3(g)��������ѹǿ���ٸı�ʱ����Ӧ�ﵽƽ��״̬
���𰸡�B
��������
A�����ڷ�ӦH2(g)+I2(g)![]() 2HI(g)����Ӧǰ�������������ȣ���С��Ӧ���������ƽ�ⲻ�ƶ������淴Ӧ����������ͬ�ı�����A����
2HI(g)����Ӧǰ�������������ȣ���С��Ӧ���������ƽ�ⲻ�ƶ������淴Ӧ����������ͬ�ı�����A����
B��̼���������䣬˵�������淴Ӧ������ȣ���Ӧ�Ѵ�ƽ��״̬��B��ȷ��
C�����º��������£���A��CͬʱΪ���壬��ѹǿ����ʱ��Ҳ��˵����Ӧ�ﵽƽ��״̬��C����
D����ӦN2(g)+3H2(g)![]() 2NH3(g)�ں�ѹ�����½��У��������ѹǿʼ�ղ��䣬D����
2NH3(g)�ں�ѹ�����½��У��������ѹǿʼ�ղ��䣬D����
��ѡB��


 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д� â���̸������Ծ�ϵ�д�
â���̸������Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϣ�ͨ�����õ�ⷨ�������Է�ˮ�е�![]() ��װ��ʾ��ͼ��ͼ��ʾ������˵����ȷ����
��װ��ʾ��ͼ��ͼ��ʾ������˵����ȷ����
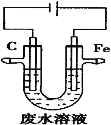
A.ʯī���Ϸ���������Ӧ
B.�����ĵ缫��ӦʽΪ![]()
C.��ȥ![]() �ķ�Ӧ��
�ķ�Ӧ��![]()
D.���ŵ��Ľ��У�ʯī�������������Һ��pH���С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȼ�շ��ⶨij�����л���![]() �ķ�����ɣ��ⶨװ��ͼ��ʾ���г��������ƾ��Ƶ�����ȥ����
�ķ�����ɣ��ⶨװ��ͼ��ʾ���г��������ƾ��Ƶ�����ȥ����

ȡ![]() ����װ���У�ͨ�����
����װ���У�ͨ�����![]() ȼ�գ�����
ȼ�գ�����![]() ��
��![]() ����ش������й����⣺
����ش������й����⣺
��1��ͨ�����![]() ��Ŀ����_________��
��Ŀ����_________��
��2��![]() װ�õ�������________________��
װ�õ�������________________��![]() װ�õ�������___________��
װ�õ�������___________��
��3��ͨ����ʵ���ܷ�ȷ��![]() ���Ƿ�����ԭ��________����ܡ����ܡ�����
���Ƿ�����ԭ��________����ܡ����ܡ�����
��4����![]() ��Ħ������Ϊ
��Ħ������Ϊ![]() ��
��![]() װ������
װ������![]() ��
��![]() װ������
װ������![]() ����
����![]() �ķ���ʽΪ________��
�ķ���ʽΪ________��
��5��д��![]() ȼ�յĻ�ѧ����ʽ��________________��
ȼ�յĻ�ѧ����ʽ��________________��
��6��![]() �ɷ���ˮ�ⷴӦ��
�ɷ���ˮ�ⷴӦ��![]() ��ˮ������2�ֻ�Ϊͬ���칹��IJ���������ֲ����Ϊ
��ˮ������2�ֻ�Ϊͬ���칹��IJ���������ֲ����Ϊ![]() ����
����![]() �ڴ���������ˮ��Ļ�ѧ����ʽΪ_____��
�ڴ���������ˮ��Ļ�ѧ����ʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʮ��������ѧ�����߶�̼����������⻯�����˹㷺������о���ȡ����һЩ��Ҫ�ɹ�����֪��C(s)��O2(g)��CO2(g)����H����393 kJ��mol��1
2CO (g)��O2(g)��2CO2(g)����H����566 kJ��mol��1
2H2(g)��O2(g)��2H2O(g)����H����484 kJ��mol��1
��1����ҵ�ϳ����ý�ˮ�����絽���ȵ�̿����ʵ��ú���������Ƶ�CO��H2�����÷�Ӧ���Ȼ�ѧ����ʽ��_______________��
��2������ú��������������̿�㽻�����������ˮ���������������Ŀ����__________�������������ڼ��Ⱥʹ����ºϳ�Һ��ȼ�ϼ״����÷�Ӧ����ʽΪ_______________��
��3�����ӹ�ҵ��ʹ�õ�һ����̼���Լ״�Ϊԭ��ͨ�����⡢�ֽ�������Ӧ�õ���
��һ����2CH3OH(g) === HCOOCH3(g)+2H2(g) ��H>0
�ڶ�����HCOOCH3(g) === CH3OH(g) +CO(g) ��H>0
���Լ״���һ����̼�ķ�ӦΪ___________��Ӧ��������������������������
��4����ѧ���õ����ز�����ͭ��װ��ͼ���˹����ϵͳ�����ø�װ�óɹ���ʵ������
CO2��H2O�ϳ�CH4��
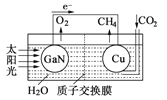
��д��ͭ�缫����ĵ缫��Ӧʽ____________��
��Ϊ��߸��˹����ϵͳ�Ĺ���Ч�ʣ�����װ���м�������___________��ѡ����������������������������
��5����Ȼ��Ҳ��������������ԭ�ϣ������ѧ����������Ȼ��������������÷�����X������������X����Է�������Ϊ106����˴Ź���������ͼ����X�Ľṹ��ʽΪ_____________��
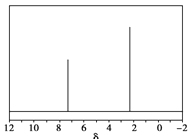
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪0.1 mol��L��1�Ĵ�����Һ�д��ڵ���ƽ�⣺CH3COOH![]() CH3COO����H����Ҫʹ��Һ��c(H��)/c(CH3COOH)ֵ�����Բ�ȡ�Ĵ�ʩ��( )
CH3COO����H����Ҫʹ��Һ��c(H��)/c(CH3COOH)ֵ�����Բ�ȡ�Ĵ�ʩ��( )
���������ռ���� �������¶� �������������� ����ˮ
A.�٢�B.�ڢ�C.�ۢ�D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����«��( )�㷺������ʳ��(����ɣ�ء�����������������)�У������ܾ��п����ԡ��ش��������⣺
)�㷺������ʳ��(����ɣ�ء�����������������)�У������ܾ��п����ԡ��ش��������⣺
(1)��������˵����ȷ����________��
a.��ʹ����KMnO4��Һ��ɫ
b.����FeCl3��Һ��������ɫ
c.��ʹ���CCl4��Һ��ɫ
d.����NH4HCO3��Һ���ò�������
e.�����ڴ���
(2)1 mol �û������������________ mol NaOH��
(3)1 mol �û�������Br2��Ӧʱ���������________ mol Br2��
(4)1 mol�û�������H2�ӳ�ʱ��������ı�״���µ�H2�����Ϊ________ L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����1.0Lcmol/LCH3COOH��Һ��0.1molNaOH�����ϣ�ʹ֮��ַ�Ӧ��Ȼ����û����Һ�м���CH3COOH ��CH3COONa����(����������¶ȱ仯)��������ҺpH�ı仯��ͼ��ʾ�����������������

A. ���¶��£�����ĵ���ƽ�ⳣ��Ka=![]()
B. a���Ӧ�Ļ����Һ��c(CH3COOH)>c(Na+)>c(OH-)
C. ˮ�ĵ���̶�:c>b>a
D. �������Һ������ʱ��c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡm g���ԭ������ΪM��ij����������ϡ���ᷴӦ���ڱ�״���²���a L�������÷�Ӧ���ɵ��������н���Ԫ�صĻ��ϼ�Ϊ(����)
A. ��aM/(22.4m) B. ��am/(11.2M) C. ��11.2m/(aM) D. ��aM/(11.2m)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����Ȼ�ѧ����ʽ��Zn(s) +![]() O2(g) ��ZnO(s) ��H1����351.1kJ/mol
O2(g) ��ZnO(s) ��H1����351.1kJ/mol
Hg(l) +![]() O2(g) �� HgO(s) ��H2����90.7kJ/mol
O2(g) �� HgO(s) ��H2����90.7kJ/mol
�ɴ˿�֪Zn(s) + HgO(s) �� ZnO(s) + Hg(l)����H3��������H3��ֵ��
A.��260.4 kJ/molB.��254.6 kJ/molC.��438.9 kJ/molD.��441.8 kJ/mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com