
| A. | 生成0.025 mol P2O5 | |
| B. | 生成 P2O3所释放的热量为(Y-0.05X) kJ | |
| C. | 2P(s)+$\frac{3}{2}$O2(g)=P2O3(s)△H=-(40Y-2X)kJ•mol-1 | |
| D. | 生成的 P2O3与 P2O5的质量之比为 1:1 |
分析 0.1molP在2.24L O2(标准状况下)燃烧至反应物耗尽,故P原子与O原子的数目之比为0.1mol:$\frac{2.24}{22.4}$mol×2=1:2,2:5<1:2<2:3,故反应产物为P2O3、P2O5,令物质的量分别为xmol、ymol,则:2x+2y=0.1、3x+5y=0.2,
解得:x=0.025mol,y=0.025mol
故P2O3的质量为0.025mol×110g/mol=2.75g,P2O5的质量为0.025mol×142g/mol=3.55g,据此分析解答.
解答 解:A、根据以上分析,0.1molP在2.24L O2(标准状况下)燃烧至反应物耗尽,故P原子与O原子的数目之比为0.1mol:$\frac{2.24}{22.4}$mol×2=1:2,2:5<1:2<2:3,故反应产物为P2O3、P2O5,故A正确;
B、根据以上分析,生成P2O3的物质的量为0.025mol,生成P2O5的物质的量为0.025mol,又单质磷(P)的燃烧热为X kJ/mol,所以生成 P2O3所释放的热量为(Y-0.05X) kJ,故B正确;
C、由B得出,生成P2O3的物质的量为0.025mol,释放的热量为(Y-0.05X) kJ,所以2P(s)+$\frac{3}{2}$O2(g)=P2O3(s)△H=-(40Y-2X)kJ•mol-1,故C正确;
D、根据以上分析,生成的 P2O3与 P2O5的质量之比为2.75g:3.55g,故D错误;
故选:D.
点评 本题考查反应热的有关计算、热化学方程式的书写等,难度中等,判断生成物的成分是解题的关键,注意理解燃烧热的含义.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na | B. | Mg | C. | Cu | D. | Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
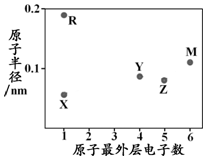
| A. | 简单阳离子半径:X<R | B. | 最高价含氧酸的酸性:Z<Y | ||
| C. | M的氢化物常温常压下为气体 | D. | X与Y可以形成正四面体结构的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| ① | ② | ③ | ④ | ⑤ |
| 物质所含的微粒数 | 固体体积 | 溶液的质量百分比浓度 | 标准状况下气体的摩尔体积 | 非标准状况下某物质的质量 |
| 阿伏加德罗常数 | 固体密度 | 溶液体积 | 标准状况下气体的体积 | 物质的摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室制备溴苯可用如图所示装置.填空:
实验室制备溴苯可用如图所示装置.填空: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 2NH3(g)△H=-92kJ/mol.
2NH3(g)△H=-92kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④②⑤③ | B. | ④①②⑤③ | C. | ②⑤④①③ | D. | ④⑤②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
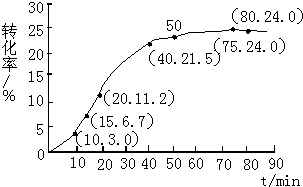 甲酸甲酯水解反应方程式为:
甲酸甲酯水解反应方程式为:| 组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
| 物质的量/mol | 1.00 | 1.99 | 0.01 | 0.52 |
| 反应时间范围/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均反应速率/(10-3mol•min-1) | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com