


科目:高中化学 来源: 题型:
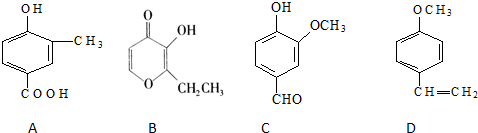
| 元素 | 相关结构和性质 |
| A | 其单质的一种晶体不是金属晶体,但是电的良导体,且难熔、质软并有润滑性,可用作原子核反应堆的慢化剂、火箭发动机喷灌和电极材料等. |
| B | 其单质既能与强酸溶液反应,又能与强碱溶液反应,其简单离子在第三周期单核离子中半径最小. |
| C | 是蛋白质的组成元素之一,原子核外有三种不同能量的电子,且未成对电子数最多. |
| D | 原子核外最外层电子排布式为nsnnp2n+1 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
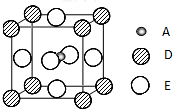 (2010?泰州三模)已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2.
(2010?泰州三模)已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2.查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D | |
| 性质或结构信息 | 室温下单质呈气态,原子最外层电子数与D相同. | D3B中阳离子与阴离子的电子层结构相同 | A和C可形成两种常见的化合物甲和乙,乙具有弱酸性 | 单质质软,银白色固体,导电性强,在空气中燃烧生成淡黄色固体 | E是一种气态氧化物丙,丙相对于空气的密度为3.0,溶解于水可得只含单一溶质的弱酸性溶液,该溶液在光照条件下放置酸性会增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com