
����Ŀ�������̿�ۣ���Ҫ����MnO2��������������Fe2O3��Al2O3�����ʣ�Ϊԭ���Ʊ��ߴ�MnO2����������ͼ��ʾ��
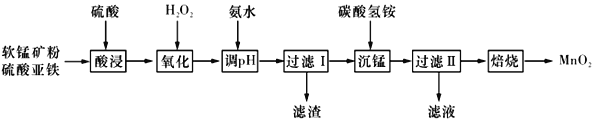
��֪���ٳ����£�Ksp[Fe(OH)3]=8.0��10-38��Ksp [Al(OH)3]=4.0��10-34��
�ڳ����£��������������������Al3+��Fe3+��ȫ������pH�ֱ�Ϊ4.6��3.4��Mn2+��ʼ������pHΪ8.1��
�۳����£�����Һ�н����������ʵ���Ũ��С�ڻ����1��10-5mol��L-lʱ������Ϊ�ý��������ѱ�������ȫ��
��1��������������в�����Ũ����������ᣬԭ����_____________________���������ʱ����һ���������ᣬ����ܹ������١������ᡱ������ɰ�����ʧ���������ʱ���������ʱ���к��ɫ�����֣�ԭ����___________________________________��
��2�����백ˮӦ����pH�ķ�ΧΪ______����Fe3+ǡ�ó�����ȫʱ��c(Al3+)=________mol��L-l��
��3�������ˡ���������ΪMnCO3����Һ�����ʵ���Ҫ�ɷ���____________���ѧʽ����д���������ӵĵ���ʽ��_______________________________��
��4������̼����鱗��������Ĺ��̳�Ϊ�����̡���
�١����̡������зų�CO2������Ӧ�����ӷ���ʽΪ_______________________________��
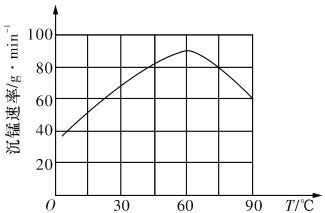
�ڡ����̡������г����������¶ȵĹ�ϵ��ͼ��ʾ�����¶ȸ���60��ʱ���������������¶����߶�������ԭ�������_______________________________��
���𰸡� �������̻�����Ũ���� ���ɵ�Fe3+ˮ��õ�Fe(OH)3���� 4.6~8.1 0.05 (NH4)2SO4 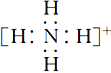 Mn2++2HCO3-=MnCO3��+CO2��+H2O �¶ȹ���ʱ̼����淋ķֽ����������ӿ죬����������̼�����Ũ�ȵļ�С������
Mn2++2HCO3-=MnCO3��+CO2��+H2O �¶ȹ���ʱ̼����淋ķֽ����������ӿ죬����������̼�����Ũ�ȵļ�С������
����������1��������������в�����Ũ����������ᣬԭ���Ƕ������̻�����Ũ�������������ʱ����һ���������ᣬ����ܹ������١���������������ɰ�����ʧ���������ʱ���������ʱ���к��ɫ�����֣�ԭ�������ɵ�Fe3+ˮ��õ�Fe(OH)3������
��2����������Ϣ��֪��Al3+��Fe3+��ȫ������pH�ֱ�Ϊ4.6��3.4��Mn2+��ʼ������pHΪ8.1�����ԣ����백ˮӦ����pH�ķ�ΧΪ4.6~8.1����Fe3+ǡ�ó�����ȫʱ�������ʵ���Ũ�����ֵΪ1��10-5mol��L-l����ʱ��Һ��c(OH-)����СֵΪ![]() mol/L��c(Al3+)=
mol/L��c(Al3+)=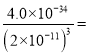 0.05mol��L-l��
0.05mol��L-l��
��3������������������ΪMnCO3����Һ�����ʵ���Ҫ�ɷ���(NH4)2SO4���������ӵĵ���ʽΪ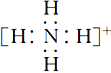 ��
��
��4�����������������зų�CO2������Ӧ�����ӷ���ʽΪMn2++2HCO3-=MnCO3��+CO2��+H2O��
�ڵ��¶ȸ���60��ʱ���������������¶����߶�������ԭ����������¶ȹ���ʱ̼����淋ķֽ����������ӿ죬����������̼�����Ũ�ȵļ�С��������


 �Űٷֿ�ʱ����ϵ�д�
�Űٷֿ�ʱ����ϵ�д� ������״Ԫ��ҵϵ�д�
������״Ԫ��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��һ�ֳ�����Ԫ�أ����Զ�����ʽ�㷺��������Ȼ��֮�С�
��1���Ǽʿռ���ڶ����л����Ӻ������ӣ�����������̼Ԫ�أ�C2��һ���Ǽʷ��ӣ�C2��C60��Ϊ_______________��
��2��CO2��̼Ԫ����Ҫ��������ش������й����⣺
������CO2��Na2O2��Ӧ���������������ṩ�������䷴Ӧ����ʽΪ_________________��
�ڹ�ҵ�Ͽ���CO2��NH3��һ�������ºϳ����أ���Ӧ����ʽΪ2NH3+CO2![]() CO(NH2)2+H2O��
CO(NH2)2+H2O��![]() ʱ��CO2��ת������ʱ��ı仯��ϵ��ͼ��ʾ��
ʱ��CO2��ת������ʱ��ı仯��ϵ��ͼ��ʾ��
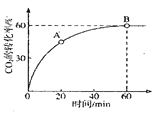
A����淴Ӧ����![]() __________B�������Ӧ����
__________B�������Ӧ����![]() (����ڡ�С�ڡ����ڡ�)��NH3��ƽ��ת����Ϊ____________��
(����ڡ�С�ڡ����ڡ�)��NH3��ƽ��ת����Ϊ____________��
�����ŶԻ���������ʶ�����룬CO2��ת�����������ѳ�Ϊ�����ȵ�֮һ���Ը����������Ķ��Ե缫���������ɵ��CO2ת��ΪCO��װ��ʾ��ͼ���£�
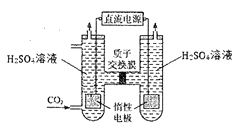
д��ͨCO2��缫��Ӧʽ_________________��
��CO2����������̼�����ϡ���������(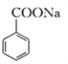 ��дΪC6H5COONa)Ҳ��ijЩ���ϵ����Ӽ��������־����������á��о�����������(C6H5COOH)���־������������ڱ������ơ���������ij���ϵĹ����У��������ӱ��������⣬�����ѹ����CO2���塣������̼��Ķ������룬��д��̼���뱽�����Ʒ�Ӧ�����ӷ���ʽ__________________��������÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ______________����ѹ����CO2�����ϵ��־�����������ǿ������������ӷ���ʽ������ԭ��_______________����֪��H2CO3��Ka1��4.17��10��7��C6H5COOH��Ka��6.25��10��5������
��дΪC6H5COONa)Ҳ��ijЩ���ϵ����Ӽ��������־����������á��о�����������(C6H5COOH)���־������������ڱ������ơ���������ij���ϵĹ����У��������ӱ��������⣬�����ѹ����CO2���塣������̼��Ķ������룬��д��̼���뱽�����Ʒ�Ӧ�����ӷ���ʽ__________________��������÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ______________����ѹ����CO2�����ϵ��־�����������ǿ������������ӷ���ʽ������ԭ��_______________����֪��H2CO3��Ka1��4.17��10��7��C6H5COOH��Ka��6.25��10��5������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʯ��ʯī��Ϊ̼��ͬ�������壬��������ʱ����ȼ������һ����̼�����ȼ��ʱ���ɶ�����̼����Ӧ�зų���������ͼ��ʾ��

��1��д��ʯīת��Ϊ���ʯ���Ȼ�ѧ����ʽ____________________________________��
��2��д��ʯī�Ͷ�����̼��Ӧ����һ����̼���Ȼ�ѧ����ʽ_____________________��
��3����ѧ���״���X�����⼼���۲쵽CO��O�ڴ��������γɻ�ѧ���Ĺ��̡���Ӧ���̵�ʾ��ͼ���£�
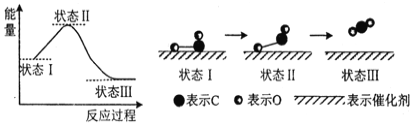
���ж�CO��O����CO2�Ƿ��ȷ�Ӧ��������__________________��
��д��CO2�ĵ���ʽ___________________��CO2���еĻ�ѧ�������ǣ��������ۼ�����������Ի�Ǽ��ԣ�______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1mol Naת��ΪNa+ʱʧȥ�ĵ�����Ϊ�� ��
A.3.01��1023
B.6.02��10��23
C.1.204��1023
D.6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ִ���ᣬ����Խ��Խ��ע��ʳ�е�Ӫ���ɷ֡��⡢��ͺ����ʳ�ﺬ�зḻ�������������Ӧ����Ϊ�� ��
A.����B.����C.Ԫ��D.ͬλ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����1������ϩ����ͨ������ϩ����ϩ���������ӳɷ�Ӧ�õ�

��2��ʵ��֤�������з�Ӧ�з�Ӧ����ӵĻ���˫���Ȼ���˫�������ױ�������
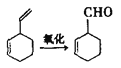
��3��R-CHO +H2�� R-CH2OH�ֽ��Զ���ϩΪ�л�ԭ�ϣ����Լ���ѡ��������;���ϳɼ������飺
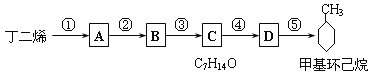
�밴Ҫ����գ�
��1��A�Ľṹ��ʽ��___________________��B�Ľṹ��ʽ��______________ ��
��2��д�����з�Ӧ�Ļ�ѧ����ʽ�ͷ�Ӧ���ͣ�
��Ӧ�� ____________________________ ����Ӧ����______________��
��Ӧ��_____________________________ ����Ӧ���� __________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʲ�������Ȼ�߷��ӻ�������ǣ� ��
A.����B.��˿C.ֲ����D.��ά��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������л�����Ľṹ�����ش�
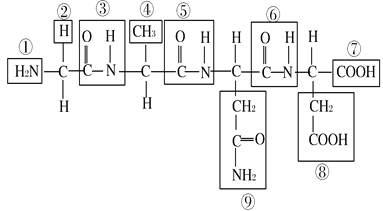
(1) �û������У�����ʾ ������ʾ ��
(2) �û������� ��������ʧȥ ��ˮ���Ӷ��γɣ����ַ�Ӧ���� ��
(3) �û������еİ��������ͬ������ �����ģ������� ��
(4) �û������Ϊ ���� ���ļ�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A(C2H4)�ǻ������л�����ԭ�ϡ���A�ͳ������л���ɺϳ�һ���������Ϻ�һ����ȩ�����ϣ�����ϳ�·����ͼ��ʾ�����ַ�Ӧ������ȥ����

��֪��

�ش��������⣺
��1��B�ķ���ʽ��___________��C�к��еĹ����������� ____________��
��2����DΪ��ȡ�������廯��������������Ʒ�Ӧ��ÿ��D������ֻ����1����ԭ�ӣ�D����Ԫ�ص���������ԼΪ13.1%����D�Ľṹ��ʽΪ___________���ķ�Ӧ������________________��
��3���ݱ�������Ӧ�����������£���NaHSO4��H2OΪ�������У���д���˷�Ӧ�Ļ�ѧ����ʽ��____________________________________��
��4����д���������������ı���ȩ������ͬ���칹��Ľṹ��ʽ��___________________��
i .���б�����![]() �ṹ
�ṹ
ii.�˴Ź���������4��壬�ҷ����֮��Ϊ3��2��2��1
��5����������EΪ�����ѵ�ͬϵ�����Է��������ȱ����Ѵ�14������ʹFeCl3��Һ��ɫ��E������ͬ���칹�干��(�����������칹)________________�֡�
��6������ �ĺϳ�·�ߣ�д����2-�ȱ���ͱ�Ҫ�����Լ��Ʊ�
�ĺϳ�·�ߣ�д����2-�ȱ���ͱ�Ҫ�����Լ��Ʊ� �ĺϳ�����ͼ��_______________________________________
�ĺϳ�����ͼ��_______________________________________
�ϳ�����ͼʾ�����£�CH2 = CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com