
| A. | CH4 C2H4 C3H4 | B. | CH4 C2H6 C2H2 | C. | C2H2 C2H4 C3H4 | D. | C2H2C3H6 C4H8 |
分析 令烃的平均组成CxHy,则:CxHy+(x+$\frac{y}{4}$)O2$\frac{\underline{\;点燃\;}}{\;}$xCO2+$\frac{y}{2}$H2O(l),根据体积变化,利用差量法计算,然后根据平均值法确定成份.
解答 解:设混合烃的平均组成为CxHy,则:
CxHy+(x+$\frac{y}{4}$)O2$\frac{\underline{\;点燃\;}}{\;}$xCO2+$\frac{y}{2}$H2O(l),气体体积缩小△V
1 $\frac{y}{4}$+1
V mL 2V mL
故 $\frac{y}{4}$+1=2,解得y=4,
即混合气体分子中平均含有4个H原子即可,
A.CH4、C2H4、C3H4以任意比例混合,H原子平均值为4,符合题意,故A不选;
B.CH4 C2H6 C2H2混合,平均H原子数目可能为4,符合题意,故B不选;
C.C2H2 C2H4 C3H4混合,平均H原子数目介于2~4之间,小于4,不符合题意,故C选;
D.C2H2C3H6 C4H8混合气体,平均H原子数目可能为4,符合题意,故D不选;
故选:C.
点评 本题考查混合物的有关计算,难度中等,注意差量法与平均值法的运用,侧重对学生思维能力的考查.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为△H=-890kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890 kJ?mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)$?_{500℃,30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ?mol-1 | |
| C. | 已知:H2(g)+F2(g)═2HF(g);△H=-270 kJ/mol,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| D. | 在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、N03- | |
| B. | pH为11的溶液:S2-、SO32-、SO42-、Na+ | |
| C. | 水电离出来的c (H+)=10-13 mol/L的溶液:K+、HCO3一、Br一、Ba2+ | |
| D. | 无色溶液:K+、CO32-、N03-、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S既作氧化剂又作还原剂 | B. | 消耗12gC时,反应转移5mol电子 | ||
| C. | 还原产物只有K2S | D. | KNO3只发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
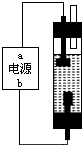 饮用水安全在灾后重建中占有极为重要的地位,为防止灾后疫病要使用大量的各种消毒液,如NaClO溶液,某学习小组对消毒液次氯酸钠(NaClO)的制备与性质进行研究.
饮用水安全在灾后重建中占有极为重要的地位,为防止灾后疫病要使用大量的各种消毒液,如NaClO溶液,某学习小组对消毒液次氯酸钠(NaClO)的制备与性质进行研究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,A的名称是2-甲基戊烷. 若A是炔烃B氢化而成,则B的结构有2种
,A的名称是2-甲基戊烷. 若A是炔烃B氢化而成,则B的结构有2种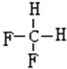 和
和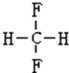 F.
F.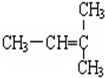 和
和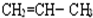 G.
G.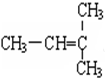 和
和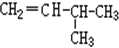
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 状态 | 密度/g•cm3 | 沸点/℃熔点/℃ |
| 乙醇 无色液体 | 0.79 | 78.5/-130 |
| 1,2-二溴乙烷 无色液体 | 2.2 | 132/9 |
| 乙醚 无色液体 | 0.71 | 34.6/-116 |
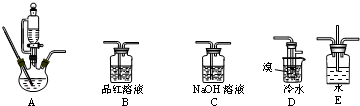
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com