
【题目】恒温条件下,可逆反应:2NO(g)+O2(g)![]() 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态.
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
【答案】A
【解析】试题分析:可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析。①υ(NO2)正=2υ(O2)逆,证明正逆反应速率相等,化学反应达到了平衡状态,故正确;②υ(NO)正=2υ(O2)正,只能体现反应的正反应方向,不能证明正逆反应速率相等,化学反应不一定达到了平衡状态,故错误;③化学反应进行到任何程度,化学反应速率之比均等于方程式的系数之比,所以用NO2、NO、O2表示的反应速率的比为2:2:1的状态不一定是平衡状态,故错误;④混合气体颜色不再改变,证明二氧化氮的浓度不随时间的改变而改变,证明达到了平衡状态,故正确;⑤混合气体密度ρ=![]() ,质量在反应前后是守恒的,体积保持不变,所以密度自始至终都不变,所以混合气体密度不改变的状态不一定是平衡状态,故错误;⑥反应是一个前后气体系数和变化的反应,当混合气体压强不再改变的状态是平衡状态,故正确;⑦混合气体平均相对分子质量M=
,质量在反应前后是守恒的,体积保持不变,所以密度自始至终都不变,所以混合气体密度不改变的状态不一定是平衡状态,故错误;⑥反应是一个前后气体系数和变化的反应,当混合气体压强不再改变的状态是平衡状态,故正确;⑦混合气体平均相对分子质量M=![]() ,质量在反应前后是守恒的,反应是一个前后气体系数和变化的反应,即n是变化的,所以M不变证明反应达到了平衡状态,故正确,故选A。
,质量在反应前后是守恒的,反应是一个前后气体系数和变化的反应,即n是变化的,所以M不变证明反应达到了平衡状态,故正确,故选A。


科目:高中化学 来源: 题型:
【题目】某温度时,在一个容积为2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应的化学方程式为_____________________。
(2)反应开始至2 min,气体Z的平均反应速率为______________。
(3)若X、Y、Z均为气体,反应达到平衡时:

①压强是开始时的_________倍;
②若此时将容器的体积缩小为原来的![]() 倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为_______反应(填“放热”或“吸热”)。
倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为_______反应(填“放热”或“吸热”)。
(4)若上述反应在2 min后的t1~t6内反应速率与反应时间图象如下,在每一时刻均改变一个影响反应速率的因素,则(_____)
A.在t1时增大了压强
B.在t3时加入了催化剂
C.在t4时降低了温度
D. t2~t3时X的转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于2X(g)![]() Y(g)的体系,在压强一定时,平衡体系中Y的质量分数w(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态)。
Y(g)的体系,在压强一定时,平衡体系中Y的质量分数w(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态)。

(1)该反应的正反应方向是一个________反应(“吸热”或“放热”)。
(2)A、B、C、D、E各状态中,v正<v逆的点是____________。
(3)维持t1不变,E→A所需时间为x,维持t2不变,D→C所需时间为y,则x ______ y(填“<”、“>”或“=”)。
(4)欲使E状态从水平方向到C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃,101kPa下,16g气态CH4充分燃烧生成液态水时放出890kJ热量.请计算:
(1)112LCH4(标准状况)在25℃,101kPa下,充分燃烧生成液态水时放出的热量;
(2)上述过程中同时产生二氧化碳的体积(标准状况).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于离子反应,同时又属于有颜色变化的氧化还原反应的是( )
A. 氢气和氯气混合点燃
B. 氯化钡溶液和硫酸溶液混合
C. 把铜放入硫酸汞溶液中
D. 氯化铁溶液与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
① C2H2(g) +5/2O2(g) == 2CO2(g)+H2O(l) ΔH1=-1301.0 kJmol-1
② C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
③ H2(g)+ ![]() O2(g) == H2O(1) △H3 = -285.8 kJ·mol-1
O2(g) == H2O(1) △H3 = -285.8 kJ·mol-1
则反应④ 2C(s)+ H2(g) == C2H2(g)的△H为( )
A. +228.2 kJ·mol-1 B. -228.2 kJ·mol-1
C. +1301.0 kJ·mol-1 D. +621.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的分类都正确的是(括号里的是类别)
A. 空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、CO2(非电解质)
B. 液氨(氢化物)、NH4Cl(铵盐)、HNO3(含氧酸)、NaOH(强电解质)
C. HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(碱性氧化物)、CH3I(卤代烃)
D. NO2(酸性氧化物)、CH3CHO(有机物)、CO(有机物)、CH3COOCH3(酯)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量混合气体在密闭容器中发生如下反应:mA(g)+nB(g) ![]() pC(g),达到平衡后,温度不变,将气体体积压缩到1/2,当达到平衡时C的浓度为原来的1.9倍,则下列叙述正确的是( )
pC(g),达到平衡后,温度不变,将气体体积压缩到1/2,当达到平衡时C的浓度为原来的1.9倍,则下列叙述正确的是( )
A. m+n>p B. A的转化率增加
C. 平衡向逆反应方向移动 D. C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对温室气体二氧化碳的研究一直是科技界关注的重点。
I.在催化剂存在下用H2还原CO2是解决温室效应的重要手段之一,相关反应如下:
主反应:CO2(g)+4H2(g)=CH4(g)+2H2O(g)
副反应:CO2(g)+H2(g)=CO(g)+H2O(g)
(1)工业上提高甲烷反应选择性的关键因素是____________。
(2)T℃时,若在体积恒为2L的密闭容器中同时发生上述反应,将物质的量之和为5mol的H2和CO2以不同的投料比进行反应,结果如图所示。若a、b表示反应物的转化率,则表示H2转化率的是____________,c、d分别表示CH4(g)和CO(g)的体积分数,由图可知![]() =____________时,甲烷产率最高。
=____________时,甲烷产率最高。
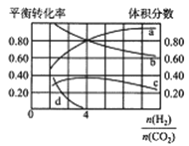
Ⅱ.CO2加氢合成低碳烯烃的技术在节能减排等方面具有重要意义,由CO2和H2合成CH3OH的反应如下:CO(g)+3H2(g)=CH3OH(g)+H2O(g) △H,在10L的恒容密闭容器中投入1molCO2和2.75molH2,在不同条件下发生上述反应,测得平衡时甲醇的物质的量随温度、压强的变化如图所示。
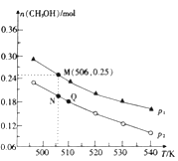
(3)判断P1____________P2 (填“大于”、“小于”或“等于”)
说明理由_____________________________________。
(4)经测定Q点时容器的压强是反应前压强的9/10,若反应从开始到平衡所需的时间为5min,则05min内H2的反应速率v(H2)=____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com