
【题目】分析、归纳、探究是学习化学的重要方法和手段之一。下面就电解质A回答有关问题 (假定以下都是室温时的溶液)。
(1)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=a
①当a =10时,A溶液呈碱性的原因是(用离子方式程式表示)___________________。
②当a =11,n =1时,A溶液中各种离子浓度由大到小的顺序为_____________________, c(OH-)-c(HB)=________ mol/L。
③当n=1、c=0.1,溶液中c(HB)∶c(B-)=1∶999时,A溶液的pH为______(保留整数值)。
(2)已知难溶电解质A的化学式为XY2,测得其饱和溶液中X2+离子的浓度为c mol/L,则该难溶物XY2的溶度积常数为Ksp=_______。
【答案】 Bn-+H2O![]() HB(n-1)-+OH- c(Na+)>c(B-)>c(OH-)>c(H+) 1×10-11 10 4c3
HB(n-1)-+OH- c(Na+)>c(B-)>c(OH-)>c(H+) 1×10-11 10 4c3
【解析】(1)①NanB溶液的pH=10,NanB为强碱弱酸盐,在溶液中发生水解,溶液显碱性,水解方程式为Bn-+H2O![]() HB(n-1)-+OH-;②当a=11,n=1时,由于B-离子水解,溶液显碱性,溶液中B-离子浓度减小,所以A溶液中各种离子浓度由大到小的顺序为c(Na+)>c(B-)>c(OH-)>c(H+);由电荷守恒可得:c(B-)+c(OH-)=c(H+)+c(Na+),由物料守恒可知:c(Na+)=c(HB)+c(B-),将钠离子浓度带入电荷守恒可得:c(B-)+c(OH-)=c(H+)+c(HB)+c(B-),c(OH-)-c(HB)=c(H+)=1×10-11;③n=1、c=0.1,c(HB)∶c(B-)=1∶999,说明参与水解的B-离子为0.1%,水解生成的氢氧根离子浓度为:0.1mol/L×0.1%=0.0001mol/L,则溶液的pH为10;(2)已知难溶电解质A的化学式为XY2,测得其饱和溶液中X2+离子的浓度为c mol/L,则Y-浓度是2c mol/L,因此该难溶物XY2的溶度积常数为Ksp=c×(2c)2=4c3。
HB(n-1)-+OH-;②当a=11,n=1时,由于B-离子水解,溶液显碱性,溶液中B-离子浓度减小,所以A溶液中各种离子浓度由大到小的顺序为c(Na+)>c(B-)>c(OH-)>c(H+);由电荷守恒可得:c(B-)+c(OH-)=c(H+)+c(Na+),由物料守恒可知:c(Na+)=c(HB)+c(B-),将钠离子浓度带入电荷守恒可得:c(B-)+c(OH-)=c(H+)+c(HB)+c(B-),c(OH-)-c(HB)=c(H+)=1×10-11;③n=1、c=0.1,c(HB)∶c(B-)=1∶999,说明参与水解的B-离子为0.1%,水解生成的氢氧根离子浓度为:0.1mol/L×0.1%=0.0001mol/L,则溶液的pH为10;(2)已知难溶电解质A的化学式为XY2,测得其饱和溶液中X2+离子的浓度为c mol/L,则Y-浓度是2c mol/L,因此该难溶物XY2的溶度积常数为Ksp=c×(2c)2=4c3。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】下列所给的化学反应中,不属于氧化还原反应的是
A. CaCO3+2HCl = CaCl2+CO2↑+H2O
B. Fe+CuSO4 =Cu+FeSO4
C. Fe2O3+3CO![]() 2Fe+3CO2↑
2Fe+3CO2↑
D. 2Cl2+2Ca(OH)2 = CaCl2+Ca(ClO)2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的红外光谱和核磁共振氢谱图如下图所示,下列说法中错误的是
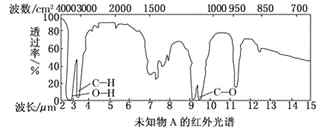
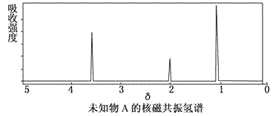
A. 由红外光谱可知,该有机物中至少有三种不同的化学键
B. 若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
C. 仅由其核磁共振氢谱图无法得知其分子中的氢原子总数
D. 由核磁共振氢谱图可知,该有机物分子中有三种不同的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取氯化铁粉末,已知氯化铁粉末很容易吸水生成结晶化合物FeCl3+6H2O===FeCl3·6H2O。
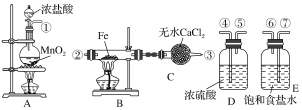
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):
①接_______________________________________________________
(2)烧瓶A发生的反应中,氧化剂是________(填物质名称),B中反应的化学方程式是___________________。
(3)容器D的作用是_____________________________________________,容器E的作用是__________________________________________________。
(4)A、B中的酒精灯应先点燃________处(填“A”或“B”)的酒精灯,理由是___________________。
(5)这套实验装置是否完整?________(填“是”或“否”),若不完整,还须补充________装置(若第一问填“是”,则此问不需要作答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T K时,向2.0L恒容密闭容器中充入0.10molCOCl2,发生反应![]() ,经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表,下列说法正确的是:
,经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表,下列说法正确的是:
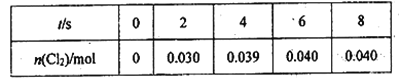
A. T K时该反应的化学平衡常数为![]()
B. 反应在前2s的平均速率![]() mol·L-1·s-1
mol·L-1·s-1
C. 保持其他条件不变,升高温度,若新平衡时c(C12)=0.038 mol·L-1,则反应的△H < 0
D. 平衡后向上述容器中再充入0.10molCOCl2,平衡正向移动,COCl2的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物种类较多,有N2O、NO、N2O3、NO2、N2O4、N2O5等,它们应用广泛。
(1)N2O是人类最早应用于医疗的麻醉剂之一。它可由NH4NO3在加热条件下分解产生,此反应的化学方程式为______________________________。
(2)N2O4可作火箭高能燃料N2H4的氧化剂。已知:2NO2(g)![]() N2O4(g)△H=﹣akJmol﹣1;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣bkJmol﹣1;N2(g)+2O2(g)=2NO2(g)△H=+ckJmol﹣1;(a、b、c均大于0)。写出气态肼(N2H4)在气态(N2O4)中燃烧生成氮气和气态水的热化学方程式________。
N2O4(g)△H=﹣akJmol﹣1;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣bkJmol﹣1;N2(g)+2O2(g)=2NO2(g)△H=+ckJmol﹣1;(a、b、c均大于0)。写出气态肼(N2H4)在气态(N2O4)中燃烧生成氮气和气态水的热化学方程式________。
(3)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压 × 物质的量分数[例如p(NO2)=p总×x(NO2)]。则反应2NO2(g)N2O4(g)△H=﹣akJmol﹣1平衡常数Kp表达式为______(用p总、和各气体物质的量分数x表示)。
(4)新型绿色硝化剂N2O5可以通过N2O4为原料用电解法制备,实验装置如图所示。则电极B接直流电源的___极,电解池中生成N2O5的电极反应式为______________。
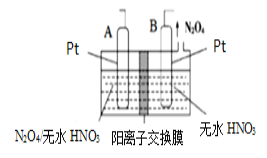
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对电负性的理解不正确的是( )
A.电负性是人为规定的一个相对数值,不是绝对标准
B.元素电负性的大小反映了元素原子对键合电子吸引力的大小
C.元素的电负性越大,则元素的非金属性越强
D.元素的电负性是元素固有的性质,与原子结构无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是生活中常用的去油污洗涤剂。某同学欲用碳酸钠晶体(Na2CO310H2O)配制100mL1molL-1的纯碱溶液。请回答下列问题:
(1)计算所需要Na2CO310H2O的质量为________g;
(2)取该溶液20mL稀释到100mL后的溶液中c(Na+)为_______molL-1。
(3)完成上述实验,除下图所示的仪器外,还需要添加的玻璃仪器是__________________________。
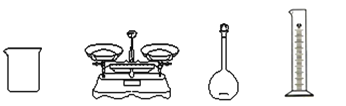
(4)配制溶液时,下列实验操作会使配制溶液浓度偏低的是__________。
A.容量瓶内有水,未经过干燥处理
B.定容操作时,俯视刻度线
C.向容量瓶中转移时有少量液体溅出
D.定容后倒转容量瓶几次,发现液面最低点低于刻度线,再补加几滴水到刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于常见有机物的说法不正确的是
A. 乙醇与乙酸都可以与钠反应
B. 油脂是油和脂肪的统称,都是高级脂肪酸与甘油形成的酯
C. 1mol有机物 一定条件下能和6molNaOH反应
一定条件下能和6molNaOH反应
D. 分于式为C4H7ClO2,可与NaHCO3溶液反应产生CO2的有机物可能结构有6种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com