
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素D在周期表中的位置__________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)______。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有________________________________________________________________________。
(4)若E是金属元素,其单质与氧化铁反应常用于焊 接钢轨,请写出反应的化学方程式:________________________________________________________________________。
接钢轨,请写出反应的化学方程式:________________________________________________________________________。
若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:_______________ ___________________________________________________
___________________________________________________
_________________________________ _______________________________________。
_______________________________________。
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式_____________________________________________________________________________
_______________ _________________________________________________________。
_________________________________________________________。
解析:A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期, C与F同主族,C 元素的原子最外层电子数是次外层电子数的三倍,所以C是O元素;C与F同主族,且是短周期元素,F是S元素;D与E和F同周期,D是所在周期原子半径最大的主族元素,D是Na元素;A与D同主族,且原子序数最小,为H元素;又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,E处于钠和硫之间,所以是固体,则只能是A和B形成气体单质,A的原子序数小于B,A是H元素,B是N元素。
元素的原子最外层电子数是次外层电子数的三倍,所以C是O元素;C与F同主族,且是短周期元素,F是S元素;D与E和F同周期,D是所在周期原子半径最大的主族元素,D是Na元素;A与D同主族,且原子序数最小,为H元素;又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,E处于钠和硫之间,所以是固体,则只能是A和B形成气体单质,A的原子序数小于B,A是H元素,B是N元素。
(1)钠位于第三周期第IA族
(2)离子的电子层数越多其半径越大,相同电子层结构的离子半径随着原子序数的增大而减小,所以离子半径大小顺序是S2-> O2-> Na+
(3) 由A、B、C三种元素以原子个数比4∶2∶3形成的化合物X是硝酸铵,硝酸铵中含有离子键、共价键。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,说明E是铝元素,高温下,铝和氧化铁能发生置换反应,化学方程式为2Al+Fe2O3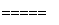 Al2O3+2Fe;若E是非金属元素,其单质在电子工业中有重要应用,E是硅,二氧化硅和强碱反应生成硅酸盐和水,离子方程式为:SiO2+2OH-===SiO
Al2O3+2Fe;若E是非金属元素,其单质在电子工业中有重要应用,E是硅,二氧化硅和强碱反应生成硅酸盐和水,离子方程式为:SiO2+2OH-===SiO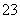 +H2O
+H2O
(5)二氧化硫有毒,和水反应生成亚硫酸,亚硫酸不稳定容易被氧气氧化生成硫酸,化学方程式为:2SO2+O2+2H2O===2H2SO4
答案:(1)第三周期第IA族 (2)S2-> O2-> Na+ (3)离子键、共价键
(4)2Al+Fe2O3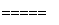 Al2O3+2Fe SiO2+2OH-===SiO
Al2O3+2Fe SiO2+2OH-===SiO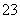 +H2O
+H2O
(5)2SO2+O2+2H2O===2H2SO4


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
乙醇与重铬酸根离子在酸性溶液中能发生如下反应:C2H5OH+Cr2O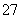 +H+―→CO2↑+Cr3++H2O,当这个方程式配平后,H+的化学计量数为( )
+H+―→CO2↑+Cr3++H2O,当这个方程式配平后,H+的化学计量数为( )
A.10 B.12
C.14 D.16
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4 + 6Na2O2===2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑
①该反应中的氧化剂是________,还原剂是________,每生成1 mol Na2FeO4转移________mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用__________________________________
________________________________________________________________________。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO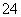 、Cl-、H2O。
、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:____________________________
________________________________________________________________________。
②每生成1 mol FeO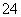 转移________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________mol。
转移________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y为短周期元素,X原子各电子层的电子数比为1∶4∶1,它比Y原子多3个电子。下列叙述错误的是( )
A.X离子半径小于Y离子半径
B.X单质在空气中燃烧不止生成一种化合物
C.Y的氢化物的稳定性比同族元素的高
D.X、Y形成的化合物属于共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见( )
A. NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的热化学方程式为:NH4HCO3+HCl===NH4Cl+CO2↑+H2O ΔH=+Q
查看答案和解析>>
科目:高中化学 来源: 题型:
红磷(P)和Cl2发生反应生成PCl3和PCl5,反应过程和能量的关系如下图所示,图中的ΔH表示生成1 mol产物的数据。已知PCl5分解生成PCl3和Cl2,该分解反应是可逆反应。下列说法正确的是( )
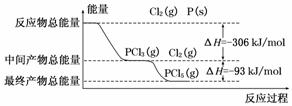
A.其他条件不变,降低温度有利于PCl5的生成
B.反应2P(s)+5Cl2(g)===2PCl5(g)对应的反应热 ΔH=-798 kJ/mol
C.P和Cl2反应生成PCl3的热化学方程式为:2P(s)+3Cl2(g)===2PCl3(g) ΔH=-306 kJ/mol
D.其他条件不变,对于2PCl5(g)===2P(s)+5Cl2(g) ΔH反应,增大压强,PCl5的转化率减小,ΔH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
恒温时,在一固定容积的容器内发生如下反应:2NO2(g) N2O4(g)。达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡相比,NO2的体积分数( )
N2O4(g)。达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡相比,NO2的体积分数( )
A.不变 B.增大 C.减小 D.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com