
| A. | ①②③ | B. | .①②④ | C. | ②③④ | D. | 全部正确 |
分析 ①降低反应物浓度、降低温度都能减缓反应速率;
②原电池能加快反应速率;
③同一反应中不同物质的化学反应速率与其计量数之比越大该反应速率越快;
④采用极限法计算Z浓度.
解答 解:①降低反应物浓度、降低温度都能减缓反应速率,该反应中Fe过量、稀盐酸一定量,加入适量硫酸钠溶液后混合溶液体积增大,氢离子浓度降低导致反应速率降低,且Fe和硫酸钠不反应生成氢气,所以减缓反应速率且不影响生成H2的总量,故正确;
②原电池能加快反应速率,该反应中Zn过量、稀盐酸一定量,Zn和硫酸铜发生置换反应生成Cu,Zn、Cu和电解质溶液构成原电池加快反应速率,且氢离子总物质的量不变,所以生成氢气总量不变,故正确;
③同一反应中不同物质的化学反应速率与其计量数之比越大该反应速率越快,甲:$\frac{V(X)}{1}$=0.3mol/(L.min)、乙:$\frac{V(Y)}{3}$=$\frac{1.2}{3}$ mol/(L.min)=0.4 mol/(L.min)、丙:$\frac{V(E)}{3}$=$\frac{0.8}{3}$ mol/(L.min)=0.27 mol/(L.min)、丁:$\frac{V(F)}{2}$=$\frac{0.9}{2}$ mol/(L.min)=0.45 mol/(L.min),所以反应速率大小顺序是丁>乙>甲>丙,所以反应速率最快的是丁,故错误;
④如果Z完全转化为X2、Y2,则Z的浓度为0,如果X2完全转化为Z,则生成Z物质的量浓度是0.2mol/L,加上原来的Z,所以共有0.4mol/L,实际上这几种物质都有,所以Z的浓度为0-0.4mol/L之间,所以当反应达到平衡时,Z的浓度有可能为0.3mol/L,故正确;
故选B.
点评 本题考查化学平衡计算及化学反应速率影响因素,为高频考点,明确化学反应原理及化学平衡计算方法是解本题关键,侧重考查学生理解、分析、计算能力,注意①②中限制性条件“改变反应速率但不影响生成氢气总量”,注意:原电池能加快反应速率.


科目:高中化学 来源: 题型:实验题
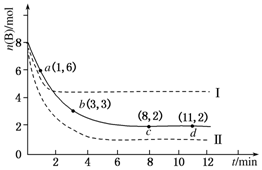
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
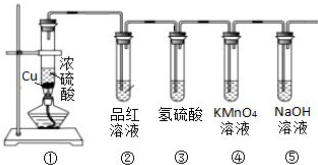
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | N2 | H2 | NH3 |
| 反应前 | 16mol | xmol | 0 |
| 5min | ymol | 28mol | 8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
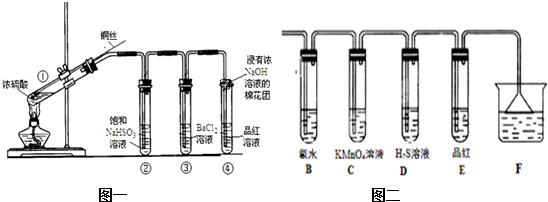
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
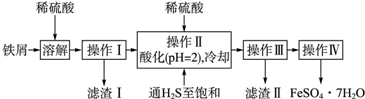
| 25℃时 | pH[] |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为296×10-3mol•L-1•s-1 | |
| B. | 该温度下的反应平衡时N2O5的转化率为29.6% | |
| C. | 1000s后,其它条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,则c(N2O5)<5.00mol/L | |
| D. | 反应达平衡后,其他条件不变,升高温度平衡常数将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
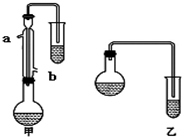 某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如下表:
某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如下表:| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com