
【题目】无水氯化铝是一种重要的化工原料,工业上利用明矾石制备无水氯化铝的流程如图,请回答下列问题: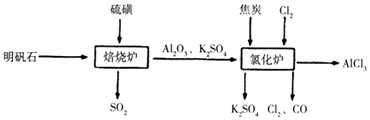
(1)实验室中,可制得Cl2的组合是(填代号).
①MnO2和浓盐酸混合共热 ②MnO2、NaCl和浓硫酸混合共热
③NaClO和盐酸混合共热 ④漂白粉和硫酸混合共热
(2)吸收焙烧炉中产生的尾气,下列装置合理的是(填代号).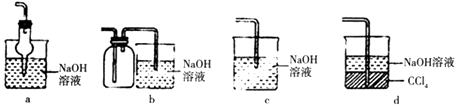
(3)写出氧化炉中反应的化学方程式
(4)生产氯化铝的过程中焙烧炉和氯化炉中产生的SO2、Cl2等大气污染物,若将二者按照一定比例通入水中可减少污染.试设计简单实验检验二者是否恰好完全反应,简要描述实验步骤、现象和结论(仪器自选).
可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
(5)某同学设计用如图装置验证二氧化硫的某些化学性质.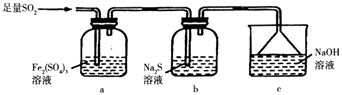
①能说明二氧化硫具有氧化性的实验现象为 .
②写出a瓶中发生反应的离子方程式 .
③充分反应后,取a瓶中的溶液分成三份,分别进行如下实验.
实验I:向第一份溶液中加入足量的NaOH溶液,生成白色沉淀,迅速变为灰绿色,最终变为红褐色.
实验II:向第二份溶液中加入少量KMnO4溶液,紫色褪去.
实验III:向第三份溶液中加入BaCl2溶液,生成白色沉淀.
上述实验中能充分证明二氧化硫具有还原性的是:(填实验代号).
【答案】
(1)①②③④
(2)ad
(3)3C+Al2O3+3Cl2 ![]() 3CO+2AlCl3
3CO+2AlCl3
(4)取二者溶于水后的溶液少许置于试管中,向其中加入品红溶液,若品红不褪色,说明二者恰好完全反应,否则,两者未完全反应
(5)b中出现淡黄色沉淀;2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+;Ⅰ和Ⅱ
【解析】解:(1)①MnO2和浓盐酸混合共热生成氯化锰、氯气和水,故正确;
②NaCl和浓硫酸混合共热能生成浓盐酸再与MnO2混合共热生成氯化锰、氯气和水,故正确;
③NaClO和盐酸混合共热,其中次氯酸根、氢离子、氯离子混合反应生成氯气和水,故正确;
④漂白粉和硫酸混合共热,其中次氯酸根、氢离子、氯离子混合反应生成氯气和水,故正确;
故选:①②③④;(2)a.干燥管球形处容积较大,溶液倒吸后会于烧杯内的液体分离,由重力作用又回到烧杯内,可以防止倒吸,故a正确;
b.广口瓶中进气管长,出气管短,不能防止倒吸,应进气管短,故b错误;
c.导管直接伸入液面内,会发生倒吸危险,故c错误;
d.二氧化硫经过四氯化碳后,被氢氧化钠溶液吸收,可以防止倒吸,故d正确,
故选:ad;(3)由流程图可知,氯化炉中氧化铝、碳、氯气反应生成氯化铝、CO,反应方程式为:3C+Al2O3+3Cl2 ![]() 3CO+2AlCl3 , 所以答案是:3C+Al2O3+3Cl2
3CO+2AlCl3 , 所以答案是:3C+Al2O3+3Cl2 ![]() 3CO+2AlCl3;(4)取二者溶于水后的溶液少许置于试管中,向其中加入品红溶液,若品红不褪色,说明二者恰好完全反应,否则,两者未完全反应,
3CO+2AlCl3;(4)取二者溶于水后的溶液少许置于试管中,向其中加入品红溶液,若品红不褪色,说明二者恰好完全反应,否则,两者未完全反应,
所以答案是:取二者溶于水后的溶液少许置于试管中,向其中加入品红溶液,若品红不褪色,说明二者恰好完全反应,否则,两者未完全反应;(5)①硫化钠溶液里通SO2发生反应的离子方程式为SO2+2S2﹣+2H2O=3S↓+4OH﹣ , 此反应体现了SO2的氧化性,看到的现象是b中出现淡黄色沉淀,所以答案是:b中出现淡黄色沉淀;
②二氧化硫能被硫酸铁溶液氧化,生成硫酸根离子和亚铁离子,反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+ ,
所以答案是:2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+;
③实验Ⅰ中有氢氧化亚铁沉淀生成,实验Ⅱ中有亚铁离子生成,都说明二氧化硫将铁离子还成亚铁离子,说明二氧化硫具有还原性,所以实验Ⅰ和Ⅱ都说明二氧化硫具有还原性,所以答案是:Ⅰ和Ⅱ.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶.其先后顺序正确的是( )
A.②④⑤③①
B.③②④①⑤
C.③④②⑤①
D.②④③⑤①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质属于同系物的是( )
A.![]() 和
和 ![]()
B.CH3CH2Cl和CH2ClCH2CH2Cl
C.C2H5OH和CH4O
D.CH3COOH和C17H33COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B为单质,C为化合物:A+B ![]() C
C ![]()
![]() A+B.能实现上述转化关系的是( )
A+B.能实现上述转化关系的是( )
①若C溶于水后得到强碱溶液,则A可能是Na
②若C的溶液遇Na2CO3 , 放出CO2气体,则A可能是H2
③若C的溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C的溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu.
A.①②
B.②④
C.①③
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是 ( )
① pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低
② 1 L 0.50 mol·L-1NH4Cl 溶液与2 L 0.25 mol·L-1NH4Cl 溶液含NH4+ 物质的量完全相等
③ pH相等的四种溶液:a.CH3COONa b.NaClO c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d < b < c < a
④ pH=8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-)> c(H2CO3)
⑤ pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-) ≤ c(H+)
⑥ pH=4浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+)
A. ③⑤⑥ B. ①③⑤ C. ①②④ D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为: 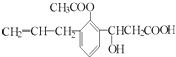 ,则此有机物可发生的反应类型有( )
,则此有机物可发生的反应类型有( )
①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦加聚 ⑧中和.
A.①②④⑤⑥⑦⑧
B.②③④⑤⑥⑧
C.②③④⑤⑥⑦⑧
D.①②③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)用单线桥表示下列反应中电子转移方向和数目:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
(2)钙元素是人体必需的常量元素,所有的细胞都需要钙元素.测定人体血液中钙元素的含量常用到如下两个反应:①CaC2O4+H2SO4=H2C204+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是;若收集到44.8mL(标准状况)的CO2时,消耗氧化剂mol,有mol电子发生转移,相当于测出含钙元素的质量是g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用15molL﹣1浓硫酸,按下列步骤配2505mL0.1molL﹣1H2SO4溶液,请回答有关问题.
(1)完成下列表格:
实验步骤 | 有关问题 |
①计算所需浓硫酸的体积 | 需取浓硫酸()mL |
②量 取浓硫酸 | 需要用到的主要仪器是: |
③将 浓硫酸并搅拌 | 该操作要做到胆大心细,杜绝事故发生 |
④待溶液冷却至室温,将烧杯中溶液转移至 mL容量瓶中 | 要注意把洗涤液一并转移至容量瓶中 |
⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1﹣2cm处后的正确操作是: |
(2)本实验不需要用到的仪器是
a.玻璃棒 b.烧杯 c.天平 d胶头滴管
(3)在进行④步操作时,不慎将溶液溅到容量瓶外,则配制溶液的浓度将(填写偏高、偏低、不影响.下同).若配制时容量瓶没有干燥,则配制溶液浓度将 .
(4)某研究人员应用如图研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸汽.请回答下列问题:
①浓硫酸的作用是 .
②通入Cl2后,从集气瓶B中干燥的有色布条的现象可得出的结论是从集气瓶C中湿润的有色布条的现象可得出的结论是 .
③从物质性质的方面来看,这样的实验设计还存在事故隐患,请在图D处以图的形式表明克服事故隐患的措施.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com