
【题目】如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( )
A.所含原子数相等
B.气体密度相等
C.气体质量相等
D.摩尔质量相等
科目:高中化学 来源: 题型:
【题目】某研究性学习小组通过下列反应原理制备SO2并进行性质探究.反应原理为:Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2↑+H2O 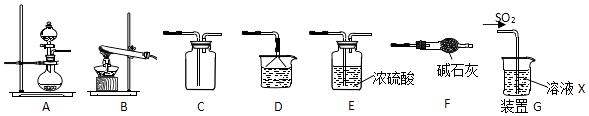
(1)根据上述原理制备并收集干燥SO2的实验装置连接顺序为 .
(2)D中盛装的试剂为 .
(3)甲同学用注射器吸取纯净的SO2并结合装置G进行SO2的性质实验,若X是Na2S溶液,其目的是检验SO2的 , 可观察到的现象 .
(4)实验1:乙同学将溶液X换为浓度均为0.1mol/L Fe(NO3)3和BaCl2的混合溶液(已经除去溶解氧),通入少量SO2后观察到烧杯产生白色沉淀,乙同学认为白色沉淀为BaSO4 , 为探究白色沉淀的成因,他继续进行如下实验验证:(已知:0.1mol/L Fe(NO3) 3的pH=2)
实验 | 操作 | 现象 | 结论和解释 |
2 | 将SO2通入0.1mol/L和BaCl2混合液 | 产生白色沉淀 | Fe3+能氧化H2SO3 |
3 | 将SO2通入和 BaCl2混合液 | 产生白色沉淀 | 酸性条件NO3﹣能将H2SO3氧化为SO42﹣ |
(5)丙同学认为以上实验只能说明Fe3+和酸性条件下NO3﹣均能将H2SO3氧化为SO42﹣ , 不能说明谁先氧化H2SO3 , 他利用提供的试剂(限选试剂:KSCN溶液,K3[Fe(CN)6]溶液,苯酚溶液,硝酸溶液)设计实验方案探究何种微粒先发生反应.请帮助他完成方案(包括操作现象和结论):取乙同学实验1后装置G中烧杯的上层清液于试管中, .
(6)丁同学在实验2过程发现,黄色溶液先变红棕色后慢慢变浅绿色,查阅资料得:Fe3++6SO2Fe(SO2)63+(红棕色).请用化学平衡移动原理解释实验2中溶液颜色变化的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为:S+2KNO3+3C═K2S+N2↑+3CO2↑,下列说法中正确的是( )
A.该反应中的还原剂为KNO3
B.该反应中C被还原
C.若消耗32gS,转移电子数为10mol
D.若生成标准状况下气体22.4L,则有0.75 mol物质被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).
(1)白磷有毒能和氯酸溶液发生氧化还原反应:3P4+10HClO3+18H2O=10HCl+12H3PO4 , 该反应的氧化产物是 , 若有1mol P4参加反应转移电子为 mol.
(2)氰化钠(NaCN)是一种化工原料,用于基本化学合成、电镀、冶金和有机合成医药、农药及金属处理等方面.
①已知:25℃时,HCN的电离平衡常数Ka=6.2×10﹣10 , H2CO3在25℃时的电离平衡常数是Ka1=4.5×10﹣7、
Ka2=4.7×10﹣11 , 则向 NaCN溶液通入少量CO2反应方程式是: .
②常温下,氰化钠能与过氧化氢溶液反应,生成碳酸氢钠和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性.该反应的化学方程式是: .
③电解法可以处理空气中的氮氧化物,用如图示电解池,将NOx在电解池中分解成无污染的N2和O2除去,两电极间是固体氧化物电解质,在一定条件下可自由传导O2﹣,电解池阴极反应为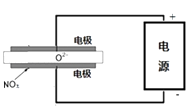
(3)①传统工业上利用氨气可以合成尿素.主要反应如下:
2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=﹣159.47kJmol﹣1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+72.49kJmol﹣1
反应2NH3(g)++CO2(g)=CO(NH2)(s)+H2O(g)的△H=kJmol﹣1
②工业上用氨气制备硝酸,将一定质量的铁粉加入到100mL某浓度的稀硝酸中充分反应后,容器中剩余m1g铁粉,此时共收集到NO气体448mL(标准状况).然后向上述混合物中加入稀硫酸至不再产生NO为止,容器剩余铁粉m2g,则m1﹣m2为 . (若铁改为铜,答案相应改正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500mL的操作,请按要求填空:
(1)用量筒量取所需浓H2SO4的体积为
(2)如果实验室有15mL、20mL、50mL量筒,应选用mL量筒最好.量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将(填偏高、偏低、无影响).
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的里,并不断搅拌,目的是
(4)将冷却后的上述溶液沿注入中,并用50mL蒸馏水洗涤烧杯次,洗涤液也要注入容量瓶中,并摇匀.如未冷却就转移,则所配溶液的浓度会(填偏高、偏低或无影响);若未洗涤烧杯,则所配溶液的浓度会(填偏高、偏低或无影响).
(5)加水至液面距刻度线下时,改用加水,使溶液的 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作正确的是( )
A. 将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液
B. 称量固体氢氧化钠时应在天平两边托盘上各放一张大小相同的同种质量的纸
C. 进行分液时,下层液体从分液漏斗下口流出,上层液体应从上口倒出
D. 蒸馏时温度计水银球应位于被蒸馏的液体中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氨的下列叙述中,错误的是 ( )
A. 氨易液化,因此液氨常用来作制冷剂
B. 氨气易溶解于水,可用来做喷泉实验
C. 实验室常用向下排空气法收集氨气
D. 氨气溶于水能导电,氨气是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.向水中加入少量稀硫酸,c(H+)增大,KW不变
C.向水中加入氨水,水的电离平衡向正反应方向移动,c(OH﹣)增大
D.pH=3的醋酸溶液,稀释至10倍后pH=4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com