
| A�� | ��H1����H2 | |
| B�� | ��������ͬ���������ڳ����¿����ת�����ǿ��淴Ӧ | |
| C�� | ����ת��Ϊ�����ķ�Ӧ�����ȷ�Ӧ | |
| D�� | ��������Ӧ���ڸ���13.2��Ļ����У���������лٻ� |
���� A�����ݢ����жϷ�Ӧ���ʱ��С��
B�������������Ļ���ת�����ڲ�ͬ�����½��У�
C�����ݷ�Ӧ���ʱ���ȷ����Ӧ�����Ȼ��Ƿ��ȣ�
D�����ݷ�Ӧ�۵��¶ȵ���13.2��Ļ���ʱSn��ת�����жϣ�
��� �⣺A�����ݢۣ�Sn��s���ң� 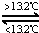 Sn��s���ף���H3=+2.1kJ•mol-1�����-��=�ۣ����ԡ�H2-��H1=��H3��0�����ԡ�H1����H2����A����
Sn��s���ף���H3=+2.1kJ•mol-1�����-��=�ۣ����ԡ�H2-��H1=��H3��0�����ԡ�H1����H2����A����
B�������������Ļ���ת�����ڲ�ͬ�����½��У����ǿ��淴Ӧ����B����
C�����ݢۣ�Sn��s���ң� 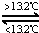 Sn��s���ף���H3=+2.1kJ•mol-1���ʱ����0�����Ի���תΪ�����ķ�Ӧ�����ȷ�Ӧ����C��ȷ��
Sn��s���ף���H3=+2.1kJ•mol-1���ʱ����0�����Ի���תΪ�����ķ�Ӧ�����ȷ�Ӧ����C��ȷ��
D�����ݢۣ�Sn��s���ң� 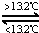 Sn��s���ף���H3=+2.1kJ•mol-1�����¶ȵ���13.2��Ļ���ʱ�������лٻ�����D��ȷ��
Sn��s���ף���H3=+2.1kJ•mol-1�����¶ȵ���13.2��Ļ���ʱ�������лٻ�����D��ȷ��
��ѡCD��
���� ���⿼��ѧ����˹���ɵ�Ӧ���Լ����ʵ����������ȶ���֮��Ĺ�ϵ���ѶȲ���ע�����֪ʶ�Ļ��ۣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʳƷ�м���ά���ػ�ơ�������Ϊ�˲���ʳƷ��ȱ����Ӫ���ɷ� | |
| B�� | ������������������������ʳ�ö����������� | |
| C�� | ʹ����ù�ؿ��ܲ���������Ӧ����ҩǰһ��Ҫ����Ƥ���������� | |
| D�� | ������Ƽ������������˶�Ա���˷̶ܳȣ������������м���ĸ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壮�����ܱ������еķ�Ӧ��N2��g��+3H2��g��?2NH3��g������H��0����673K��30Mpa��n��NH3����n��H2����ʱ��仯�Ĺ�ϵ��ͼ��ʾ������������ȷ���ǣ�������
�ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壮�����ܱ������еķ�Ӧ��N2��g��+3H2��g��?2NH3��g������H��0����673K��30Mpa��n��NH3����n��H2����ʱ��仯�Ĺ�ϵ��ͼ��ʾ������������ȷ���ǣ�������| A�� | ��c����Ӧ�ﵽƽ�� | |
| B�� | ��a������Ӧ���ʱȵ�b�Ĵ� | |
| C�� | ��d��t1ʱ�̣��͵�e��t2ʱ�̣���n��N2����һ�� | |
| D�� | �����������䣬773K�·�Ӧ��t1ʱ�̣�n��H2����ͼ��d���ֵС |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ħ�����Ϊ22.4L/mol | B�� | 1molNaOH������Ϊ40g | ||
| C�� | 0.5molCO2�����Ϊ11.2L | D�� | H2O��Ħ������Ϊ18g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH4��C2H4 | B�� |  �� CH3-CH2-CH2-CH3 �� CH3-CH2-CH2-CH3 | ||
| C�� | C2H6��C3H8 | D�� | C2H4��C3H6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壮�����ܱ������еķ�Ӧ��N2��g��+3H2��g��?2NH3��g����H��0��673K��30MPa��n��NH3����n��H2����ʱ��仯�Ĺ�ϵ��ͼ��ʾ������������ȷ���ǣ�������
�ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壮�����ܱ������еķ�Ӧ��N2��g��+3H2��g��?2NH3��g����H��0��673K��30MPa��n��NH3����n��H2����ʱ��仯�Ĺ�ϵ��ͼ��ʾ������������ȷ���ǣ�������| A�� | ��a������Ӧ���ʱȵ�b��С | |
| B�� | �� c����Ӧ�ﵽƽ�� | |
| C�� | ��d ��t1ʱ�̣� �͵� e ��t2ʱ�̣� ��n��N2����һ�� | |
| D�� | �����������䣬773K�·�Ӧ��t1ʱ�̣�n��H2������ͼ��d���ֵ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
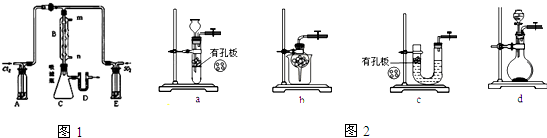
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com