
分析 ①氨水溶液呈碱性;
②NH4Cl为强酸弱碱盐,其溶液呈酸性;
③NaHSO4为强酸强碱的酸式盐,其溶液呈酸性;
④醋酸溶液呈酸性;
⑤CH3COONa为强碱弱酸盐,醋酸根离子水解导致溶液呈碱性;
⑥NaHCO3中碳酸氢根离子水解程度大于电离程度,所以其溶液呈碱性;
酸与碱对水的电离起抑制作用,而盐的水解对水的电离起促进作用,由此分析解答.
解答 解:①氨水溶液呈碱性;
②NH4Cl为强酸弱碱盐,其溶液呈酸性;
③NaHSO4为强酸强碱的酸式盐,其溶液呈酸性;
④醋酸溶液呈酸性;
⑤CH3COONa为强碱弱酸盐,醋酸根离子水解导致溶液呈碱性;
⑥NaHCO3中碳酸氢根离子水解程度大于电离程度,所以其溶液呈碱性;
酸与碱对水的电离起抑制作用,而盐的水解对水的电离起促进作用,所以
①溶液呈酸性的是②③④;
②溶液呈碱性的是①⑤⑥;
③能促进水电离的是②⑤⑥;
④能抑制水电离的是①③④;故答案为:②③④;①⑤⑥;②⑤⑥;①③④.
点评 本题考查了弱电解质的电离及盐类水解,根据“谁强谁显性、谁弱谁水解、强强显中性”确定盐溶液酸碱性,从而确定溶液pH大小,题目难度不大.


科目:高中化学 来源: 题型:解答题
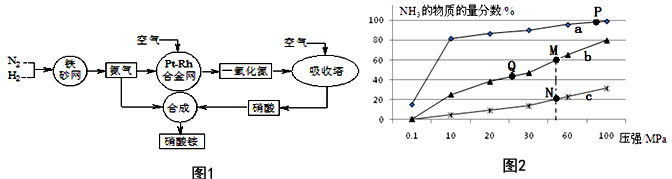
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | H2 | CO | CH4 | CH3COOH |
| 燃烧热(kJ/mol) | 286 | 283 | 890 | 874 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Fe3+肯定不存在 | |
| B. | 无色气体甲不一定是纯净物 | |
| C. | K+、Mg2+、Al3+和SO42-一定存在于溶液X中 | |
| D. | 白色沉淀乙肯定不是Al(OH)3和H2SiO3的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH2═CH2(g)+H2(g)
CH2═CH2(g)+H2(g)| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com