
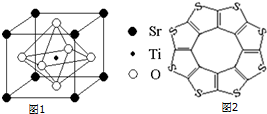
| C-S | C═S | C16S8中碳硫键 | |
| 键长/pm | 181 | 155 | 176 |
分析 Ⅰ(1)A.水合氢离子中氧原子含有3个δ键和1个孤电子对,所以其采用sp3杂化,空间构型为三角锥形;
B.O的电负性较大,对应的氢化物可形成氢键,沸点较高;
C.在冰晶体中,每个水分子与相邻的4个水分子形成氢键,利用均摊法计算;
(2)利用均摊法计算该晶胞中含有的原子个数,从而确定其化学式;
Ⅱ.(3)①处于最低能量的原子叫做基态原子,基态电子排布遵循能量最低原理、保里不相容原理和洪特规则,Ti元素为22号元素,原子核外有22个电子,根据核外电子排布规律书写;
②TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136.94℃,根据其物理性质来判断晶体类型;
(4)①一般来说,周期表从左到右,元素的电负性逐渐变大;周期表从上到下,元素的电负性逐渐变小.电负性大的元素集中在元素周期表的右上角,电负性小的元素集中在左下角;
②对于有机物利用杂化轨道数=孤对电子对数+σ键数进行判断;当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化;
③根据键长数据分析;
④分子与分子间的作用力为分子间作用力.
解答 解:I.(1)A.水合氢离子中,价层电子对数=3+$\frac{1}{2}$(6-1-3×1)=4,且含有一个孤电子对,所以其空间构型是三角锥型,故A正确;
B.氢键广泛存在于非金属性较强的元素F、O、N等元素形成的含氢化合物中,水分子间存在氢键,所以其沸点比硫化氢高,故B正确;
C.在冰晶体中,每个水分子与相邻的4个水分子形成氢键,每1个水分子平均形成2个氢键,故C错误;
故答案为:AB;
(2)该晶胞中Ti原子个数为1,O原子个数6×$\frac{1}{2}$=3,Sr原子的个数为8×$\frac{1}{8}$=1,所以化学式为SrTiO3,
故答案为:SrTiO3;
Ⅱ.(3)①Ti的原子序数为22,位于第四周期第ⅣB族,最后填充d电子,电子排布为1s22s22p63s23p63d24s2,
故答案为:1s22s22p63s23p63d24s2或[Ar]3d24s2;
②TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136.94℃,由此可判断 TiCl4是由共价键结合的分子,晶体类型属于分子晶体,
故答案为:分子晶体;
(4)①元素周期表中同周期元素从左到右元素的电负性逐渐增强,同主族元素从上到下元素的电负性逐渐减弱,所以元素的电负性是指元素的原子在化合物中把电子吸引向自己的本领,元素的非金属性强者电负性大,其单质的最高价氧化物对应的水化物的酸性越强,H2CO3的酸性远不及H2SO4的酸性强,所以元素电负性C略小于S,
故答案为:<;
②根据图2结构可知:碳原子形成2个C-S,1个C=S二键,C原子杂化轨道数为(2+1)=3,C原子采取sp2杂化方式,
故答案为:sp2;
③C-S键长为181pm,C=S键长为155pm,C16S8中碳硫键键长为176pm,键长介于C-S与C=S之间,原因可能是:分子中的C与S原子之间有π键或分子中的碳硫键具有一定程度的双键性质,
故答案为:分子中的C与S原子之间有π键或分子中的碳硫键具有一定程度的双键性质;
④分子之间存在范德华力,C16S8与H2微粒间的作用力是范德华力,
故答案为:范德华力.
点评 本题考查较为综合,涉及分子的立体构型、晶胞结构、原子在基态时的核外电子排布、氢键、杂化等知识点,题目难度中等,注意杂化轨道数判断,为高频考点.


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:选择题
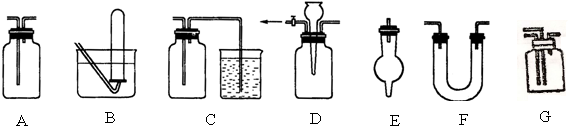
| A. | A、B装置既能用于收集Cl2,又能用于收集NO | |
| B. | 装有浓硫酸的F装置可用于干燥CO2气体 | |
| C. | C、E用于尾气吸收能防止液体倒吸到气体发生装置中 | |
| D. | G装置可用于合成氨实验中,可干燥、混合并能大致观察H2和N2的体积比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据上述热化学方程式可以确定H2、CH4的燃烧热 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(1)△H=-241.8kJ•mol-1 | |
| C. | CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(g)△H>-890.31kJ•mol-1 | |
| D. | 8gCH4完全燃烧释放出的热量为445.155kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
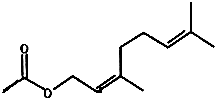
| A. | 分子式为C12H20O2 | |
| B. | 它的同分异构体中不可能有酚类 | |
| C. | 其一氯化物共7种 | |
| D. | 1mol该有机物与1mol水在一定条件下反应可能的产物有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液中滴入NaHCO3溶液有白色沉淀,原因是二者可以发生双水解反应 | |
| B. | 电解精炼铜时,若阴极得到1.204×1024个电子,则阳极质量减少6.4g | |
| C. | 使甲基橙变红色溶液:Mg2+、K+、SO42-、NO3-能大量共存 | |
| D. | Na2S在空气中长期放置变浑浊的离子方程式为:2S2-+O2+4H+=2S+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸和氢氧化钠溶液 | B. | 氢氧化镁和硝酸 | ||
| C. | 氢氧化钠溶液和稀硫酸 | D. | 氢氧化钡和稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
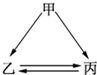 如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )
如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )| A. | ①②③⑤ | B. | ②③④⑤ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生铁中含有碳,抗腐蚀能力比纯铁强 | |
| B. | 钢铁发生析氢腐蚀时,负极反应是:Fe-3e-═Fe3+ | |
| C. | 在铁制品上镀铜时,镀件为阳极,铜盐为电镀液 | |
| D. | 铁管上镶嵌锌块,铁管不易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
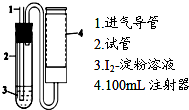 二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如下:
二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com