
| 实验编号 | 起始浓度/(mol•L-1) | 反应后溶液的pH | |
| c(HCl) | c(MOH) | ||
| ① | 0.1 | 0.1 | 5 |
| ② | 0.2 | x | 7 |
| ③ | 0.1 | 0.2 | 10 |
| ④ | 0.2 | 0.1 | y |
| A. | 实验①反应后的溶液中:c(MOH)约为1×10-5 mol•L-1 | |
| B. | 实验②反应后的溶液中:c(MOH)>c(M+)=c(Cl-)>c(H+)=c(OH-) | |
| C. | 实验③反应后的溶液中:c(M+)+c(H+)=c(OH-)+c(MOH) | |
| D. | 实验④反应后的溶液中:c(H+)-c(OH-)-c(MOH)=0.05mol•L-1 |
分析 根据图知,①等物质的量的HCl和MOH混合,二者恰好反应生成MCl,溶液呈酸性,说明MCl是强酸弱碱盐,则MOH是弱碱,弱碱离子水解导致溶液呈酸性;
②MCl是强酸弱碱盐,其水溶液呈酸性,要使混合溶液呈中性,则MOH的物质的量应该稍微大些;
③混合溶液中存在等物质的量浓度的MCl和MOH,MOH的电离程度大于M+水解程度导致溶液呈碱性,溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
④二者混合后,溶液中存在等物质的量浓度的MCl和HCl,溶液呈酸性,溶液中存在物料守恒和电荷守恒,根据物料守恒和电荷守恒判断.
解答 解:A.根据图知,①等物质的量的HCl和MOH混合,二者恰好反应生成MCl,溶液呈酸性,说明MCl是强酸弱碱盐,则MOH是弱碱,弱碱离子水解导致溶液呈酸性,水解方程式为M++H2O?MOH+H+,根据方程式知,溶液中c(MOH)≈c(H+)=1×10-5 mol•L-1,故A正确;
B.②MCl是强酸弱碱盐,其水溶液呈酸性,要使混合溶液呈中性,则MOH的物质的量应该稍微大些,但溶液中c(MOH)较小,所以c(M+)=c(Cl-)>c(MOH),故B错误;
C.③混合溶液中存在等物质的量浓度的MCl和MOH,MOH的电离程度大于M+水解程度导致溶液呈碱性,溶液中存在电荷守恒和物料守恒,根据电荷守恒得c(M+)+c(H+)=c(OH-)+c(Cl-),根据物料守恒得2c(Cl-)=c(M+)+c(MOH),所以得c(M+)+2c(H+)=2c(OH-)+c(MOH),故C错误;
D.④二者混合后,溶液中存在等物质的量浓度的MCl和HCl,溶液呈酸性,根据电荷守恒得c(M+)+c(H+)=c(OH-)+c(Cl-),根据物料守恒得c(Cl-)=2c(M+)+2c(MOH),所以得c(H+)=c(OH-)+c(M+)+2c(MOH),则c(H+)-c(OH-)-c(MOH)=c(M+)+c(MOH)=0.05mol/L,故D正确;
故选AD.
点评 本题考查离子浓度大小比较,明确溶液中的溶质及溶液酸碱性是解本题关键,难点是灵活运用电荷守恒和物料守恒,易错选项是D.


科目:高中化学 来源: 题型:选择题
| A. | 同二氧化碳一样,二氧化硅分子是由一个硅原子和两个氧原子构成的 | |
| B. | 通常状况下,二氧化碳为气态,二氧化硅为固体 | |
| C. | SiO2同CO2一样也能与CaO反应生成盐 | |
| D. | SiO2仅用来表示二氧化硅的组成,其基本结构单元为正四面体,不仅存在于二氧化硅晶体中,而且存在于所有硅酸盐矿石中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
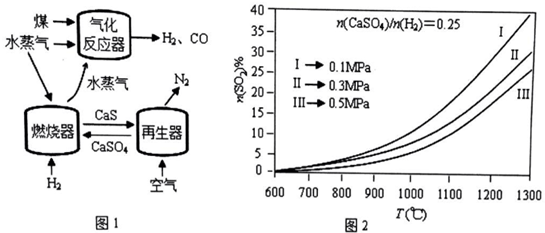
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
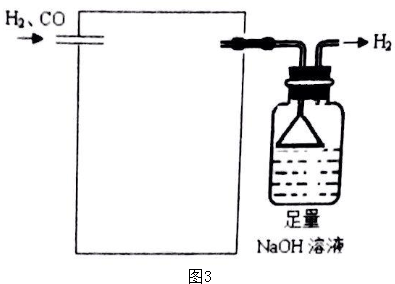
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是直链烃,但分子中碳原子不在一条直线上 | |
| B. | 在光照条件下能够与氯气发生取代反应 | |
| C. | 丙烷比其同分异构体丁烷易汽化,耗氧量少 | |
| D. | 燃烧时主要是将化学能转变为热能和光能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,48g O3含有的氧原子数为3NA | |
| B. | 17g的OH-离子中含有的电子数为0.1NA | |
| C. | 常温常压下,11.2L氧气中所含有的原子数为NA | |
| D. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
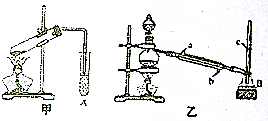 某化学兴趣小组用甲、乙两套装置(如图所示)进行甲酸(HCOOH)与甲醇(CH3OH)酯化反应的实验,回答以下问题:
某化学兴趣小组用甲、乙两套装置(如图所示)进行甲酸(HCOOH)与甲醇(CH3OH)酯化反应的实验,回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2 | B. | CH≡CH | C. | CH2=CHCH3 | D. | CH3C≡CH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com