
【题目】化合物N广泛应用于高分子材料、香料、医药、农药、防腐剂等行业,可通过如图转化得到(用键线式表示该转化)。下列说法错误的是( )
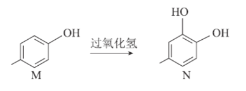
A.M→N发生氧化反应
B.M和N互为同系物
C.苯环上所连基团的种类和数目与N相同的结构还有5种(不考虑立体异构)
D.N中最多可能有15个原子共平面
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】25℃,用0.1mol·L-1的氨水滴定10mL0.05mol·L-1的二元酸H2X溶液,滴定过程中加入氨水的体积(V)与溶液中lg![]() 的关系如图所示。下列说法正确的是( )
的关系如图所示。下列说法正确的是( )
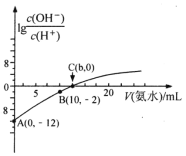
A.A点的pH等于2
B.B点溶液中离子浓度大小顺序为:c(NH4+)>c(X2-)>c(H+)>c(HX-)>c(OH-)
C.由图可知,25℃时,NH3·H2O的Kb=![]()
D.A点到C点,水的电离程度先减小后增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钼(MoS2, 其中Mo的化合价为+4)被誉为“固体润滑剂之王”,利用低品质的辉钼矿(含MoS2、SiO2 以及CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如下:

回答下列问题:
(1)“酸浸”中加入氢氟酸是为了除去杂质SiO2,该反应的化学方程式为___________。
(2)在“氧化焙烧”过程中主要是将MoS2转化为MoO3,在该反应中氧化剂与还原剂的物质的量之比为________。
(3)若氧化焙烧产物产生烧结现象,在“氨浸”前还需进行粉碎处理,其目的是_________,“氨浸”后生成( NH4)2 MoO4反应的化学方程式为___________。
(4)向“氨浸”后的滤液中加入Na2S后,钼酸铵转化为硫代钼酸铵[(NH4)2MoS4],加入盐酸后,(NH4)2 MoS4与盐酸反应生成MoS3沉淀,沉淀反应的离子方程式为_________________。
(5)高纯MoS2中仍然会存在极微量的非整比晶体MoS2.8等杂质,在该杂质中为保持电中性,Mo元素有+4、+6两种价态,则MoS2中Mo4+所占Mo元素的物质的量分数 为__________。
为__________。
(6)钼酸钠晶体( Na2 MoO4 2H2O)是一种无公害型冷却水系统金属缓蚀剂,可以由MoS2制备。在制备过程中需加入Ba(OH)2固体除去SO42-,若溶液中c(MoO42-)=0.4 mol/L,c(SO42-)=0. 05 mol/L,常温下,当BaMoO4即将开始沉淀时,SO42-的去除率为____________ [忽略溶液体积变化。已知:259℃,Ksp( BaMoO4)=4.0×10-8 , Ksp(BaSO4)=1.1×10-10]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】来源于电镀、冶金等行业的含六价铬(含Cr2O72-或CrO42-)废水具有很强的生物毒性,因此,含铬废水必须严格控制六价铬的质量浓度,达标后才能允许排放。一种处理含铬酸性废水的工艺如图所示:
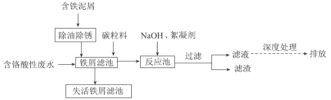
回答下列问题:
(1)去除铁屑表面油污的方法是__。
(2)酸性环境中,废水中主要存在大量Cr2O72-和少量CrO42-,原因是__(用化学用语和文字表述解释)。
(3)向“铁屑滤池"中加入碳粒料的作用是__;“铁屑滤池”中存在的Fe2+可将Cr2O72-还原,该反应的离子方程式为__。
(4)向“反应池"中加入NaOH使Cr3+沉淀,池中存在沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq)。已知:某离子浓度小于等于10-5mol·L-1时视为完全沉淀;常温下,Ksp[Cr(OH)3]=10-32。常温下,欲使废水中Cr3+完全沉淀,则溶液的pH至少应为__。
Cr3+(aq)+3OH-(aq)。已知:某离子浓度小于等于10-5mol·L-1时视为完全沉淀;常温下,Ksp[Cr(OH)3]=10-32。常温下,欲使废水中Cr3+完全沉淀,则溶液的pH至少应为__。
(5)①参照上述工艺流程知,也可采用电解原理处理含铬酸性废水,画出电解池的装置示意图并标出电极和电解质溶液的名称___(可选电极:Fe和石墨)。

②上述装置中,阳极的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种信息材料的添加剂,在相同条件下,A蒸气是同体积氢气质量的88.25倍。在A分子中各元素质量分数分别为w(C)=54.4%,w(H)=7.4%,w(O)=18.1%,w(Cl)=20.1%,A在不同条件下可发生如图所示的一系列变化。
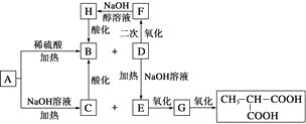
请回答下列问题:
(1)A的分子式为__________。
(2)D分子含有的官能团是________________。
(3)上述转换关系的化学方程式中,属于水解反应的有________个(填数字)。
(4)写出化学方程式:
①A和稀硫酸共热:____________________________________________________;
②E氧化成G:__________________________________________________;
③F与氢氧化钠醇溶液共热:__________________________________________。
(5)与B互为同分异构体的且属于链状酯的物质共有____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.1molL-1HA溶液中逐滴加入0.1molL-1NaOH溶液,混合溶液的pH随滴入NaOH溶液体积的变化如图所示。下列说法错误的是( )
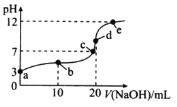
A.溶液导电性:e>d>c>b>a
B.水的电离程度:c>d>e>b>a
C.A-的水解常数:Kh≈10-9
D.b点溶液中存在![]() c(HA)=
c(HA)=![]() c(A-)+c(OH-)-c(H+)
c(A-)+c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨及甲醇生产中微量的羰基硫(COS)也可引起催化剂中毒失活,常采用水解法进行羰基硫的脱除,反应原理为COS(g)+H2O(g)![]() CO2(g)+H2S(g)。
CO2(g)+H2S(g)。
回答下列问题:
(1)已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-18kJ·mol-1。若氢气还原法脱除羰基硫的热化学方程式为COS(g)+H2(g)
CO2(g)+H2(g) △H=-18kJ·mol-1。若氢气还原法脱除羰基硫的热化学方程式为COS(g)+H2(g)![]() CO(g)+H2S(g) △H=-17kJ·mol-1,则水解法脱除羰基硫对应的反应热△H=___。
CO(g)+H2S(g) △H=-17kJ·mol-1,则水解法脱除羰基硫对应的反应热△H=___。
(2)T℃时,向体积均为2L的甲、乙两个密闭容器中,分别投入2molCOS(g)和2molH2O(g),发生反应COS(g)+H2O(g)![]() CO2(g)+H2S(g),甲在恒压条件下达到平衡,乙在恒容条件下达到平衡。
CO2(g)+H2S(g),甲在恒压条件下达到平衡,乙在恒容条件下达到平衡。
①COS的平衡转化率:甲__乙(填“>”“<”或“=”),理由是__。
②下列情况能说明甲中反应达到平衡状态的是__(填选项字母)。
A.混合气体的平均摩尔质量不再发生变化
B.H2O和CO2的消耗速率相等
C.混合气体的总压保持不变
D.H2S和CO2的体积分数之比不再变化
③乙中反应开始时压强为p0,由反应开始至达到平衡状态用时5min,达到平衡时c(H2S)=0.2mol·L-1,用COS(g)的浓度变化表示的平均反应速率为__;在化学平衡体系中,用各气体物质的分压替代浓度求得的平衡常数Kp=__。
(3)某实验室对羰基硫水解催化技术进行研究,发现在实验条件下,仅改变温度,相同时间内羰基硫水解转化率的改变如图1所示,温度高于200°C羰基硫转化率减小,可能的原因为__(任写两条);若保持温度为250℃,仅改变水蒸气含量,相同时间内羰基硫水解转化率的改变如图2所示,该图所得结论与根据方程式理论分析所得结论__(填“是”或“否”)一致,造成此结果可能的原因为__。
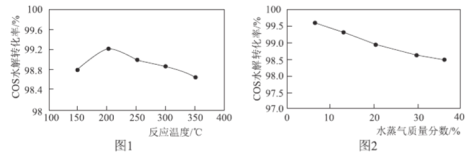
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4—CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4—CO2催化重整反应为CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g)ΔH=-75kJ·mol-1
C(s)+O2(g)=CO2(g)ΔH=-394kJ·mol-1
C(s)+![]() O2(g)=CO(g)ΔH=-111kJ·mol-1
O2(g)=CO(g)ΔH=-111kJ·mol-1
该催化重整反应的ΔH=__kJ·mol-1。有利于提高CH4平衡转化率的条件是___(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2L的容器中加入2molCH4、1molCO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为___mol2·L-2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
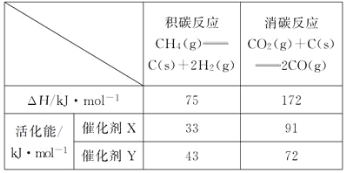
①由上表判断,催化剂X__Y(填“优于”或“劣于”),理由是___。
在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是__(填标号)。
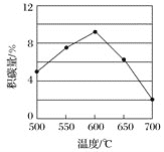
A.K积、K消均增加
B.v积减小、v消增加
C.K积减小、K消增加
D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元弱酸H2A溶液,按下式发生电离:H2A![]() H++HA-、HA-
H++HA-、HA-![]() H++A2-,下列四种溶液中c(A2-)最大的是( )
H++A2-,下列四种溶液中c(A2-)最大的是( )
A.0.01 mol·L-1的H2A溶液
B.0.01 mol·L-1的NaHA溶液
C.0.02 mol·L-1的盐酸与0.04 mol·L-1的NaHA溶液等体积混合液
D.0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液等体积混合液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com