
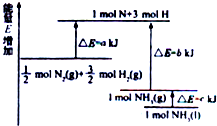
 氮及其化合物与科技、生活等密切相关.
氮及其化合物与科技、生活等密切相关.分析 (1)根据图可知,生成1molNH3(g)放出的热量为b-akJ,由气体变为液体,放出热量为CkJ,放热反应的反应热△H为负值;
(2)物质发生氧化反应,化合价要升高;根据化合价的变化结合方程式计算;
(3)①NaClO氧化NH3生成肼和氯化钠;
②依据热化学方程式和盖斯定律计算得到热化学方程式;
③肼-空气燃料电池放电时,负极上肼失电子和氢氧根离子反应生成H2O和氮气,正极上氧气得电子和水反应生成氢氧根离子,据此分析解答.
解答 解:(1)由图可知,生成1molNH3(g)放出的热量为b-akJ,则N2(g)+3H2(g)?NH3(g)△H=-(b-a)kJ/mol=(a-b)kJ•mol-1,
故答案为:N2(g)+3H2(g)?NH3(g)△H=(a-b)kJ•mol-1;
(2)在反应6NO2+8NH3$?_{△}^{催化剂}$7N2+12H2O中,NO2中N元素化合价降低,由+4价降低到0价,被还原,NH3中化合价升高被氧化,故被氧化的物质为NH3;在反应中则6molNO2参加反应,转移24mol电子,所以当转移2.4mol电子时,消耗NO20.6mol,体积为13.44L,故答案为:NH3;13.44;
(3)①制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液,反应为ClO-+2NH3=N2H4+Cl-+H2O,故答案为:ClO-+2NH3=N2H4+Cl-+H2O;
②由已知①N2(g)+2O2(g)═2NO2(g)△H=+67.7KJ/mol,②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534KJ/mol,
依据盖斯定律②×2-①得到肼与NO2完全反应的热化学方程式:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol,
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol;
③肼-空气燃料电池放电时,负极上肼失电子和氢氧根离子反应生成H2O和氮气,电极反应式为N2H4+4OH--4e-=4H2O+N2,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,
故答案为:N2H4+4OH--4e-=4H2O+N2.
点评 本题考查了化学反应能量变化的计算应用和盖斯定律的计算,热化学方程式书写方法,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | HO(CH2)2CHO | B. | CH3CH(OH)COOH | C. | HOOC-COOH | D. | HO-CH2-CH2-OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1﹕1 | B. | 1﹕m | C. | (n-4)﹕(6-n) | D. | (4-n)﹕(6-n) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. +2nH2O
+2nH2O +2H2O.
+2H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和滴定时,滴定管以及锥形瓶在使用前需用待装液润洗 | |
| B. | 测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,再对照标准比色卡读数 | |
| C. | 萃取时,振荡过程中放气是通过打开分液漏斗上口的玻璃塞进行的 | |
| D. | 做焰色反应时,可用光洁无锈的铁丝代替铂丝进行实验 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com