
分析 (1)根据电解质复原的原则:少什么加什么,结合元素守恒确定加入物质的质量;
(2)根据溶解度计算质量分数,根据电解产生的氯气的量计算溶质氯化钠的质量,进而计算溶液质量;
(3)溶液的体积V=$\frac{m}{ρ}$;
(4)根据电解方程式结合氯气的量计算氢氧化钠的量,根据公式c=$\frac{n}{V}$计算物质的量浓度.
解答 解:(1)当阳极析出11.2L即0.5mol气体(标准状况)时,阳极上是氯离子失电子,电极反应为:2Cl--2e-═Cl2↑,所以放电的氯离子是1mol,要使溶液恢复到原状态,需加入HCl气体,根据氯元素守恒,加入HCl的物质的量是1mol,质量是36.5g;
故答案为:36.5g;氯化氢气体;
(2)由氯原子守恒可知,氯化钠的物质的量是1mol,质量是58.5g,该温度下的饱和溶液的质量分数=$\frac{36g}{136g}$=$\frac{9}{34}$,所取饱和食盐水的质量=$\frac{58.5g}{\frac{9}{34}}$=221g,
故答案为:221;
(3)溶液的体积V=$\frac{m}{ρ}$=$\frac{221g}{1.2g/mL}$=153.75 mL;
故答案为:153.75;
(4)由2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,由以上分析可知,氯化钠为1mol,则生成NaOH为1mol,所以电解后溶液的浓度为c=$\frac{n}{V}$=$\frac{1mol}{0.15375L}$=6.50mol/L;
故答案为:6.50.
点评 本题涉及电解池的工作原理、质量分数的计算以及电解质复原的方法知识,属于综合知识的考查题,难度中等,侧重于考查学生对基础知识的综合应用能力和计算能力.


科目:高中化学 来源: 题型:填空题
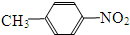 和
和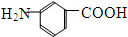 E、35Cl和37Cl
E、35Cl和37Cl查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴等浓度 FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡;试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |
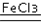 2H2O+O2↑.
2H2O+O2↑.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
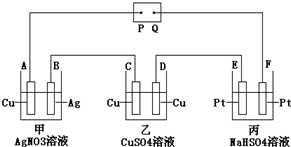
| A. | P是电源的正极 | |
| B. | F极上发生的反应为:4OH--4e-=2H2O+O2↑ | |
| C. | 电解时,甲、乙、丙三池中,除E、F两极外,其余电极均参加了反应 | |
| D. | 通电后,甲池溶液的pH减小,乙池溶液的浓度增大、丙池溶液的pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可逆反应达到化学平衡状态时,正、逆反应速率均等于零 | |
| B. | 当反应物与生成物浓度相等时,可逆反应一定已达到化学平衡 | |
| C. | 化学反应的限度决定了反应物在该条件下的最大转化率 | |
| D. | 镀锌铁制品镀层受损后,铁制品比受损前更易生锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(g)+O2(g)=SO2(g)放出热量大于297.23kJ | |
| B. | S(g)+O2(g)=SO2(g)放出热量小于297.23kJ | |
| C. | △H=-297.23kJ•mol-1表示固体S的燃烧热 | |
| D. | 形成1molSO2化学键释放的总能量大于断裂1molS(s)和1molO2(g)化学键吸收的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com