
(10分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
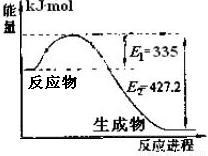
(1)右图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量为 。
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)2NH3(g),其化学平衡常数K与t的关系如下表:
| t/K | 298 | 398 | 498 | …… |
| K/(mol·L—1)—2 | 4.1×106 | K1 | K2 | …… |
请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1:3:2 B.2v(N2)(正)= v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的关系表示正确的是 (填序号)。
A.c(Cl—)>c(N2H62+)>c(H+)>c(OH—)
B.c(Cl—)>c([N2H5·H2O]+)>c(OH—)>c(H+)
C.2c(N2H62+)+c([N2H5·H2O]+)+ c(H+) =c(Cl—)+c(OH—)
D.c(N2H62+) > c(Cl—)> c(H+)>c(OH—)
(1)46.1kJ
(2)> C
(3)①N2H62++H2O[N2H5·H2O]++H+ ②AC
解析:(1)由图知生成2mol NH3放出的热量为E2﹣E1=427.2﹣335=92.2KJ,所以每生成1mol NH3放出的热量为46.1KJ。
(2) ①合成氨反应是一个放热反应,温度升高,平衡逆向移动,平衡常数K减小,所以K1>K2。
②化学平衡状态的特征是动、等、定,所以A不正确。根据化学速率比等于化学计量数之比,判断B不正确。由于该反应是一个体积缩小的反应,恒容条件,若压强不变,则达到平衡状态,C正确。密度等于质量与体积的比值,该反应总质量不变,恒容条件体积不变,所以密度在整个体系中均保持不变,故D不正确。
(3)①盐酸肼(N2H6Cl2)溶液呈酸性,则N2H62+水解,水解方程式为:N2H62++H2O[N2H5·H2O]++H+
②有水解规律知A正确,D不正确。由电荷守恒知C正确,B不正确。故选AC


科目:高中化学 来源:2012-2013学年四川省南山中学高二10月月考化学试卷(带解析) 题型:填空题
(每空1分 共10分)氮是地球上极为丰富的元素。
(1) Li3N晶体中氮以N3-的存在,基态N3-的电子排布图为 。
(2)N≡N的键能为942 kJ·mol-1,N–N单键的键能为247 kJ·mol-1,计算说明N2中的 键比 键稳定(填“σ”或“π”)。
(3)(CH3)3NH+和AlCl4-可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂 (填“大”或“小”),可用作 。(填代号)
a.助燃剂 b.“绿色”溶剂 c.复合材料 d.绝热材料
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省德阳市高三“一诊”考试化学试卷(解析版) 题型:填空题
(10分)氮是地球上含量丰富的原子元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)25℃时,0.1mol/LNH4NO3溶液中水的电离程度 (填“大于”、“等于”或“小于”) 0.1mol/L NaOH溶液中水的电离程度。
(2)若将0.1mol/L NaOH溶液和0.2mol/LNH4NO3溶液等体积混合,混合溶液中
2c(NH4+)>c(NO3-),所得溶液中离子浓度由大到小的顺序是 。
(3)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。经测定16g气体在上述反应中放出284kJ的热量。
则该反应的热化学方程式是 。
(4)右图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图。
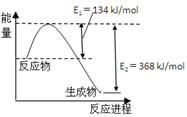
已知:N2(g)+O2(g)=2NO(g) △H=+180kJ/mol
2NO (g)+O2(g)=N2(g)+2CO2(g) △H=-112.3kJ/mol
则反应:2NO(g)+CO(g) N2(g)+2CO2(g)的△H是 。
N2(g)+2CO2(g)的△H是 。
查看答案和解析>>
科目:高中化学 来源:2014届四川省高二10月月考化学试卷(解析版) 题型:填空题
(每空1分 共10分) 氮是地球上极为丰富的元素。
(1) Li3N晶体中氮以N3-的存在,基态N3-的电子排布图为 。
(2)N≡N的键能为942 kJ·mol-1,N–N单键的键能为247 kJ·mol-1,计算说明N2中的 键比 键稳定(填“σ”或“π”)。
(3)(CH3)3NH+和AlCl4-可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂 (填“大”或“小”),可用作 。(填代号)
a.助燃剂 b.“绿色”溶剂 c.复合材料 d.绝热材料
查看答案和解析>>
科目:高中化学 来源:岳阳市2010届高三第四次质检考试(化学)试题 题型:实验题
(10分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)右图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量为 。
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g),其化学平衡常数K与t的关系如下表:
2NH3(g),其化学平衡常数K与t的关系如下表:
|
t/K |
298 |
398 |
498 |
…… |
|
K/(mol·L—1)—2 |
4.1×106 |
K1 |
K2 |
…… |
请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1:3:2 B.2v(N2)(正)= v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的关系表示正确的是 (填序号)。
A.c(Cl—)>c(N2H62+)>c(H+)>c(OH—)
B.c(Cl—)>c([N2H5·H2O]+)>c(OH—)>c(H+)
C.2c(N2H62+)+c([N2H5·H2O]+)+ c(H+) = c(Cl—)+c(OH—)
D.c(N2H62+) > c(Cl—)> c(H+) >c(OH—)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com