
【题目】同温同压下,相同体积的CO2和NO两种气体,两者的物质的量的比为_________,密度之比为___________,质子数之比为______________。
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 强电解质都易溶于水,所以BaSO4是弱电解质
B. 氨气的水溶液可以导电,但氨气属于非电解质
C. 使用催化剂可以让不自发的化学反应自发进行
D. 电解质溶液的导电过程属于物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,全部属于纯净物的是( )
A. 福尔马林、白酒、醋 B. 丙三醇、氯仿、乙醇钠
C. 苯、汽油、无水酒精 D. 甘油、冰醋酸、煤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于消去反应的是
A. 乙醇与浓硫酸共热到140℃ B. 乙醇与氢溴酸(HBr)反应
C. 乙醇与氧气反应生成乙醛 D. 乙醇与浓硫酸共热至170℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸是醋的主要成分,而醋几乎贯穿了整个人类文明史,其中有文献记载的酿醋历史至少也在三千年以上。
(1)写出乙酸在水溶液中的电离方程式_____________
(2)25℃下,CH3COOH在水中电离的ΔH为+8.8kJ/mol,电离常数Ka为2×10-5,又知HCl(aq)与NaOH(aq)反应的ΔH为-57.3kJ/mol,则CH3COONa水解时的ΔH为_____,水解平衡常数为Kh为_______。
近年来,研究者利用乙酸开发出新工艺合成乙酸乙酯,使产品成本明显降低,其主要反应为:
CH2=CH2(g)+CH3COOH(l) ![]() CH3COOC2H5(l)
CH3COOC2H5(l)
(3)该反应属于有机反应类型中的_____________。
(4)下列描述能说明乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是____________。
A.乙烯、乙酸、乙酸乙酯的浓度相同
B.酯化合成反应的速率与酯分解反应的速率相等
C.乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol
D.体系中乙烯的百分含量一定
下图为n(乙烯)与n(乙酸)物料比为1时,在不同压强下进行了在相同时间点乙酸乙酯的产率随温度的变化的测定实验,实验结果如图所示。回答下列问题:
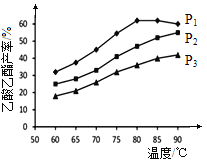
(5)温度在60~80℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是________[用![]() (P1)、
(P1)、![]() (P2)、
(P2)、![]() (P3)分别表示不同压强下的反应速率],分析其原因为____________。
(P3)分别表示不同压强下的反应速率],分析其原因为____________。
(6)压强为P1MPa、温度60℃时,若乙酸乙酯的产率为30℅,则此时乙烯的转化率为_______。
(7)压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=260kJmol﹣1
2CO(g)+2H2(g) △H=260kJmol﹣1
已知:2CO(g)+O2(g)![]() 2CO2(g) △H=﹣566kJmol﹣1
2CO2(g) △H=﹣566kJmol﹣1
则CH4与O2反应生成CO和H2的热化学方程式为 。
(2)如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
①b处电极上发生的电极反应式: ;
②电镀结束后,装置Ⅰ中KOH溶液的浓度 (填写“变大”、“变小”或“不变”),装置Ⅱ中Cu电极上发生的电极反应式: 。
③在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8g,则装置Ⅰ中理论上消耗甲烷 L(标准状况下)。

答
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小。(已知25℃,Ksp[Fe(OH)3]=4.0×10-38,lg2=0.3)
请回答下列问题:
(1)FeCl3净水的原理是 。(用离子方程式表示),Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,常温下此反应的平衡常数为 (填写数值)。
(2)将FeCl3 溶液与NaHCO3 溶液混合,其离子方程式为 。
(3)25℃时pH=3的溶液中,c(Fe3+)= molL-1。
(4)FeCl3 在溶液中分三步水解:
Fe3++H2O![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O![]() Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O![]() Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O![]() Fex+yH+,欲使平衡正向移动可采用的方法是(填序号) 。
Fex+yH+,欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
(5) FeCl3溶液可腐蚀印刷电路板,其反应为Cu +2FeCl3 =CuCl2+2FeCl2 要将此反应设计在原电池中进行,则正极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。四种元素形成的单质依次为m、n、p、q、r,t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol·L-1的v溶液中:c(OH-)/c(H+)=1.0×1010。上述物质的转化关系如图所示。下列说法正确的是
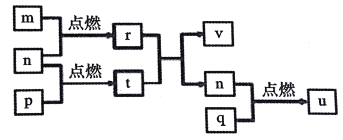
A. 原子半径的大小:W>Z>Y>X
B. Z分别与Y、W组成的化合物中化学键类型可能相同
C. v能抑制水的电离而u能促进水的电离
D. 粘有q的试管可用酒精洗涤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com