
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下: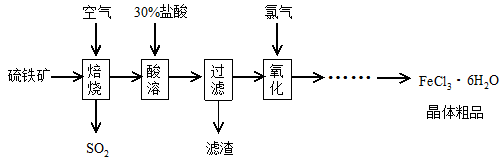
回答下列问题:
(1)焙烧硫铁矿的主要方程式为 。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、 。
(3)通氯气氧化后时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为(写化学式) 。
(4)在氧化过程中,如何检验铁元素全部以Fe3+形式存在: 。
(5)如果将氯化铁晶体(FeCl3·6H2O)放在坩埚中加热灼烧,最后得到的固体为 。
(6)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g),该反应的平衡常数表达式为K= ; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。
2SO3(g),该反应的平衡常数表达式为K= ; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。
①V2O5作崔化剂 ②通入过量O2 ③SO2、O2进行二次氧化 ④通入过量SO2
(1)4 FeS2 + 11 O2 2 Fe2O3 + 8SO2(2分)
2 Fe2O3 + 8SO2(2分)
(2)抑制Fe3+水解(2分)
(3)Cl2+Fe2+=2Cl-+Fe3+ (2分) Cl2 HCl(2分)
(4)取氧化后的溶液少许于试管中,往试管中滴加1~2滴酸性KMnO4溶液,KMnO4的紫红色不褪去,说明铁元素全部以Fe3+形式存在。(2分)
(5)Fe2O3(2分)
(6)k=c2(SO3)/c(O2)·c2(SO2) (2分) ②③(2分)
解析试题分析:(1)焙烧硫铁矿是硫酸工业中制取二氧化硫气体的重要步骤,发生的氧化还原反应配平比较困难,利用电子得失守恒配平得: 4 FeS2 + 11 O2 2 Fe2O3 + 8SO2(2分)
2 Fe2O3 + 8SO2(2分)
(2)酸溶焙烧产物不仅是提高浸出率,还可以抑制溶解得到的Fe3+水解。
(3)因为最终要得到的产品是氯化铁晶体,所以可能焙烧不完全,仍有部分亚铁离子,所以加入氧化剂氯气氧化除去,发生的反应为Cl2+Fe2+=2Cl-+Fe3+ ,该过程可能有氯气溶于水产生挥发性的HCl以及过量的Cl2,所以可以用碱吸收。
(4)检验是否全部转化为Fe3+ ,就是检验Fe2+ 的存在,所以检验Fe2+ 可以使用高锰酸钾试剂,所以操作为:取氧化后的溶液少许于试管中,往试管中滴加1~2滴酸性KMnO4溶液,KMnO4的紫红色不褪去,说明铁元素全部以Fe3+形式存在。
(5)氯化铁晶体(FeCl3·6H2O)含有水分,所以加热灼烧过程中,FeCl3 会发生水解并最终得到稳定的氧化物Fe2O3 。
(6)根据方程式可以写出平衡常数表达式为k=c2(SO3)/c(O2)·c2(SO2);要提高SO2 的转化率,则需要使平衡正向移动或SO2 二次利用,所以可行的是②、③。
考点:本题考查的是工业制硫酸和化学反应原理知识。


科目:高中化学 来源: 题型:填空题
物质A、B、C、D、E、F、G、H、I、J、K有下图转化关系,其中气体D、E为单质,试回答:
(1)写出下列物质的化学式:气体B是_____________,H是_______________,
(2)写出A与NaOH溶液反应的离子方程式:______________________________________;
(3)写出反应“I→J”的离子方程式:_____________________________________________;
(4)写出反应“F→G”的离子方程式:____________________________________________;
(5)在溶液I中滴入NaOH溶液,可观察到的现象是:_______________________________;
其反应的原理是(化学方程式)_________________________________________________.
(6)检验溶液J中的金属阳离子,用______________________试剂(填化学式),其现象是
_________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某兴趣小组用废铁泥(主要成分为Fe2O3、FeO和少量Fe)制备磁性Fe3O4纳米材料的流程示意图如下: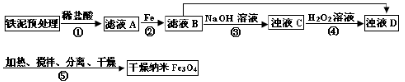
|
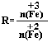 ,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。
,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。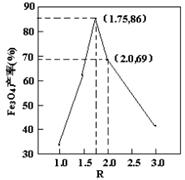
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图是传统的工业生产金属铝的基本流程图: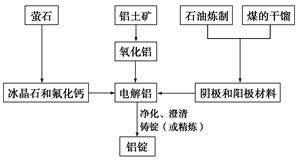
结合流程图回答下列问题:
(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是________(填化学式)。煤的干馏产物__________(填物质名称)作电解铝的阴极和阳极材料。
(2)氧化铝熔点高达2050℃,工业上为了降低能量消耗,在金属铝的冶炼过程中采取的措施是________________________________________________________________________。
(3)在冶炼过程中,阳极材料需要定期地进行更换,原因是该极材料不断被消耗,产生这种现象的原因是__________________________________________________________。
(4)工业上制取金属镁采取电解熔融MgCl2的方法,电解反应方程式为_________________,镁和铝都是活泼金属,为什么在电解冶炼过程中,一个用氯化物,一个用氧化物?________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁黄是一种重要的颜料,化学式为Fe2O3·xH2 O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含FeZ 0。及少量的CaO, Mg0等)和黄铁矿粉
(主要成分为FeS2)制备铁黄的流程如下: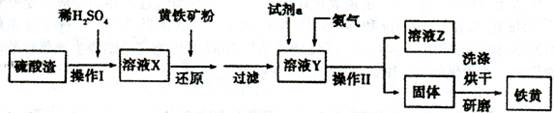
(1)操作I与操作II中都用到玻璃棒,玻璃棒在两种操作中的作用分别是_ 、
(2)试剂a最好选用_ (供选择使用的有:铝粉、空气、浓HNO3 );其作用是_ 。
(3)上述步骤中需用到氨气。下列装置可用于实验室制氨气的是_ _(填序号)。
(4)查阅资料知,在不同温度下Fe2 O3被CO还原,产物可能为Fe3 O4 、FeO或Fe,固体质量与反应温度的关系如右图所示。根据图象推断670℃时Fe2 O3还原产物的化学式为M,并设计一个简单的实验,证明该还原产物的成分(依次填写每步操作中所加试剂的化学式、现象和结论)。仪器自选。可供选择的试剂:稀H2SO4、稀盐酸、H2 O2溶液、NaOH溶液、KSCN溶液。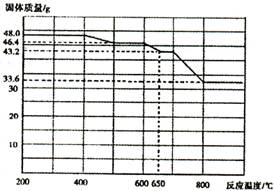
| 加入试剂 | 现象 | 结论 |
| | | 则还原产物为 |
| | | |
| | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)铜是人类最早使用的金属之一,以下是冶炼铜的一个反应:
Cu2S+2Cu2O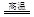 6Cu+SO2
6Cu+SO2
该反应中被氧化的元素是 ,若反应中转移1mol电子,得到Cu mol。
(2)下列两种方法均可以制备CuSO4。
方法一:2Cu+O2 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O
方法二:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
①假如某工厂欲生产CuSO4,请选择一种方法,并说明理由:
。
②有同学认为,生成等量的硫酸铜两种方法消耗的能量相同,因为反应都是铜转变为CuSO4,你认为上述说法 (填“正确”或“不正确”),原因是
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
金属钼(Mo)可以增强合金的某些机械性能和耐腐蚀性。下图是化工生产中制备金属铝的实验流程图(已知铝酸为难溶于水和酸的黄色晶体):
(1)在灼烧铝矿时发生化学反应: ,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为________。
,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为________。
(2)步骤①中,灼烧钼矿时,用于盛放固体的仪器的名称为________。
(3)写出步骤②中发生反应的离子方程式_________________________________。
(4)在步骤③中需要加入过量硝酸,检验硝酸过量的操作为_________________。
(5)某同学拟选用如下装置,用氢气还原三氧化铝,同时检验该反应的氧化产物,根据要求回答下列问题。
①若两次使用到C装置,则装置D中所盛的药品是________(填试剂名称)。
②根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞后______→______→______→______(请按正确的顺序填入下列步骤的代号)。
a.收集气体并检验其纯度 b.停止加热,充分冷却
c.加热反应一段时间 d.关闭分液漏斗活塞,停止通氢气
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁及其化合物在生活、生产中有着广泛的应用。
Ⅰ.铁触媒(+2价铁和+3价铁组成的氧化物)是工业合成氨的催化剂。某学习小组用下列流程测定铁触媒的含铁量。根据题意回答相关问题: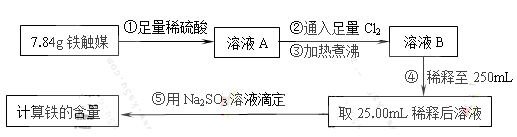
(1)步骤①中需用1.50 mol·L-1的硫酸100mL,若用18.4mol·L-1的浓硫酸来配制,则需要用量筒量取浓硫酸 mL
(2)步骤②通入Cl2的目的是 (用离子方程式表示)
(3)步骤④后需用 (填仪器名称)取25.00mL稀释后溶液。
(4)步骤⑤消耗0.10mol·L-1的Na2SO3溶液25.00mL,则铁触媒中铁的质量分数为 。
Ⅱ.目前的研究表明,铁的某些含氧酸盐可用于工业废水、废气的处理。
(1)用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,写出反应的离子反应方程式 ,处理废水时既利用K2FeO4强氧化性,又利用生成氢氧化铁胶体的 作用。
(2)MFe2O4可以与氢气反应制备新型纳米材料氧缺位铁酸盐MFe2Ox (3<x<4),其中M表示+2价的金属元素,常温下,MFe2Ox能使工业废气中的SO2转化为S,达到回收硫、净化空气目的,转化过程表示如下: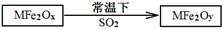
则可以判断x y,氧化性:MFe2Oy SO2(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁是一种典型的过渡金属,铁和铁的化合物在生产和生活中有广泛的应用。完成下列计算:
(1)将11.802 g钢样粉末(只含铁和碳)于高温下置于足量的纯氧中充分反应,冷却后得到16.240 g磁性氧化铁。
①钢样中含铁________g。
②生成的CO2在标准状况下体积为________mL。
(2)向10 mL氯化铁溶液(含盐酸0.001 mol)中加入16.8 g 5%的烧碱溶液(足量),充分反应后过滤。洗涤沉淀,将洗涤液与滤液合并后稀释至250mL。取25mL稀释液,用0.100 mol/L盐酸滴定,终点时消耗盐酸的体积15.50mL。计算原溶液中Fe3+的物质的量浓度。
(3)铁锈的主要成分实为羟基氧化铁[化学式FeO(OH)]。将一块带锈铁片放入700mL pH=0的稀硝酸中充分反应,收集到标准状况下NO气体3.584 L,最终剩余2.020g铁。求:
①反应后溶液中溶质的成分与物质的量。
②原带锈铁片中铁锈的质量分数。
(4)用FeSO4和NaOH制备Fe(OH)2时,往往会形成一种灰绿色的中间物(用X表示)。经分析,X中含有三种阴离子与两种阳离子,阴、阳离子的总质量之比为11:12。已知两种阳离子为Fe2+与Fe3+,物质的量之比为2:1。请通过计算确定X的化学式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com