
废易拉罐的成分比较复杂,据查,铝易拉罐各部分成分及含量(质量百分含量)见表:
| | Si | Fe | Cu | Mn | Mg | Cr | Zn | Ti | Al |
| 罐身/% | 0.3 | 0.7 | 0.25 | 0.25 | 1.0~1.5 | | | | 其余 |
| 罐盖/% | 0.2 | 0.35 | 0.15 | 0.2~0.5 | 4.0~5.0 | | 0.1 | 0.25 | 其余 |
| 拉环/% | 0.2 | 0.35 | 0.15 | 0.2~0.5 | 3.0~4.0 | 0.1 | 0.25 | 0.1 | 其余 |
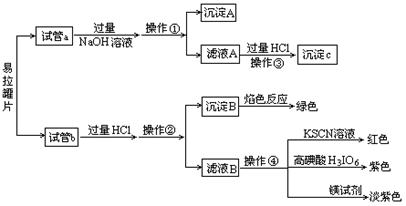
(1)漏斗、烧杯、玻璃棒(每个1分,共3分)
(2)Fe、Cu、Mn、Mg等(全对得2分,漏写得1分,错写不得分)
(3)开始生成白色沉淀,并逐渐增多,后沉淀部分溶解(2分);H++ AlO2-+H2O=Al(OH)3↓(2分);2H++ SiO32-=H2SiO3↓(2分);Al(OH)3+3H+=Al3++3H2O(2分)(书写时不要求顺序)
(4)<(2分)
解析试题分析:
(1)过滤使用到的有漏斗、烧杯、玻璃棒。
(2)不溶于NaOH溶液有Fe、Cu、Mn、Mg等。
(3)Na2SiO3和NaAlO2溶液中加入盐酸开始生成白色沉淀,并逐渐增多,后沉淀部分溶解;H++ AlO2-+H2O=Al(OH)3↓;2H++ SiO32-=H2SiO3↓;Al(OH)3+3H+=Al3++3H2O。
(4)根据金属的含量可以看出与盐酸反应的金属量多,放出气体较多。
考点:本题以实验探究为基础,考查基本化学实验、元素及其化合物知识、化学计算。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
碘是人体必需的微量元素之一,有“智力元素”之称。食用加碘食盐可预防碘缺乏病。查阅资料知:①在酸性条件下,I- 能被NO3- 氧化成IO3-,被H2O2或O2等氧化为I2;② IO3- 能被HSO3- 还原成I2。
请你利用实验室常用仪器和下列限选试剂,依次研究某食盐样品中所加碘的存在形式是I2、I-、IO3- 中的哪一种。
限选试剂如下:1.0 mol?L-1HNO3溶液、1.0 mol?L-1H2SO4溶液、1.0 mol?L-1NaHSO3溶液、3%H2O2溶液、1%淀粉溶液、蒸馏水。
(1)提出假设
假设1:该食盐样品中含I2;
假设2:该食盐样品中含I-;
假设3: 。
(2)设计方案与实验探究
将适量食盐样品溶于蒸馏水制成溶液,请按要求填写下表:
| 实验步骤 | 预期现象与结论 |
| 步骤1:取少量上述溶液注入试管中,滴入几滴淀粉溶液,振荡 | 若溶液显 (填颜色),则假设1成立;否则,假设1不成立,再进行步骤2 |
| 步骤2: | 若溶液显蓝色,则假设2成立,反应的离子方程式为 ;否则,假设2不成立,再进行步骤3 |
| 步骤3: | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
(1)判断BaCl2已过量的方法是 。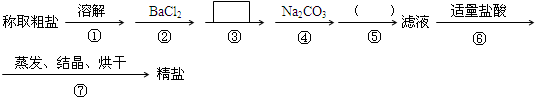
(2)第④步中,写出相应的离子方程式: ; ____________________________.
(3)在 中填写所使用除杂试剂的化学式__________,在( )中的操作名称是____ ___。
中填写所使用除杂试剂的化学式__________,在( )中的操作名称是____ ___。
(4)从实验设计方案优化的角度分析步骤②和④可否颠倒____________(填“是”或“否”,如果“否”,请说明理由。)原因是:_______________________ _______ _________________;
步骤③和④可否颠倒____________。
(5)若先用盐酸再进行操作⑤,将对实验结果产生影响,其原因是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。
(1)试剂X的化学式 。A中制取Cl2的离子方程式 。
(2)试剂Y的名称为 。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中只含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和 ;
假设2:存在三种成分:NaHCO3和 。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 | 预期现象和结论 |
 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 | |
| 步骤2:向A试管中滴加BaCl2溶液 | |
| 步骤3: | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2 ? 2H2O)。
(1)为了完成步骤I,可采用如下图所示的装置将粗铜转化为固体a。
在该实验中,加热A、C装置中的酒精灯时,应该先点燃_______装置的酒精灯,D装置的作用是
_______,C装置中生成的产物是_______。
(2)步骤II中的操作是:将步骤I中的固体加入到容器中,然后加入_______,固体完全溶解。
(3)步骤III中加入的试剂是H2O2,其目的是提高最终制备的氯化铜晶体的纯度,试写出有关反应的离子方程式______________。
(4) 步骤IV中应先加入某试剂,然后过滤得到滤液。为了调节溶液的pH只使Fe3+完全沉淀,加入的试剂是CuO粉末而不用氨水或NaOH溶液,其理由是_______。
(5)步骤V中,将溶液蒸发浓缩、冷却结晶、过滤得到CuCl2·2H2O晶体。现欲得到无水CuCl2,在实验室也可以采用上述装置完成CuCl2 ? 2H2O脱水得到无水CuCl2,则A装置中的两种化学试剂是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氯气是一种重要的化工原料。某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶和导管外还需用到的玻璃仪器有
;
(2)装置A中盛有的试剂是 ,作用是 。
(3)若D中品红溶液褪色,则B装置中发生反应的离子方程式是
(4)证明FeBr2与Cl2发生了氧化还原反应的实验方法是 (填操作方法)。
某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气。经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32- 和SO42-,对于可能存在的其他阴离子,研究小组提出以下3种假设。假设1:只存在SO32-;假设2:只存在ClO-;假设3:既不存在SO32-,也不存在ClO-。
(5)学习小组判断同时存在SO32-和ClO-是不可能的理由是 。
38.现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论。
a.3 mol/L H2SO4
b.0.01 mol/L KMnO4
c.1 mol/L BaCl2溶液
d.淀粉碘化钾溶液
e.酚酞试液
步骤一;取少量吸收液于试管中,滴加3 mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于A、B
两试管中。
步骤二:向A试管中滴加少量___________ (填序号),若溶液_________________(填现象),则假设
1成立。
步骤三:向B试管中滴加少量___________(填序号),若溶液_________________(填现象),则假设2
成立。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
钛(Ti)被誉为21世纪金属。冶炼钛的主要原料是含Fe2O3的钛铁矿(FeTiO3),其生产过程如下: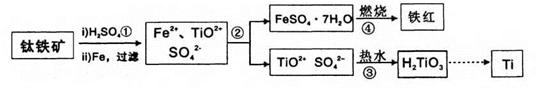
已知:TiOSO4可溶于水且易水解,H2TiO3难溶于水。试回答下列问题:
(1)步骤②的主要实验操作是冷却、结晶、 (填操作名称);步骤④在实验室中常将试剂置于 (填仪器名称)中加强热。
(2)步骤③中加入热水的作用是 。
(3)步骤④中硫酸亚铁晶体(FeSO4·7H2O)在空气中煅烧生成铁红、水和三氧化硫,写出该反应的化学方程式: 。
(4)步骤②所得到的硫酸亚铁晶体(FeSO4·7H2O)是目前工业上处理含铬有毒废水常用的化学试剂,二者反应后(Cr由+6价转化为+3价)可以转化为有重要工业价值的铁氧体复合氧化物(常用FeO·FeyCrxO3表示)。欲制备该铁氧体复合氧化物,试求在酸性的含铬废水中,加入FeSO4·7H2O的质量应为废水中六价铬(相当于CrO3)质量的 倍。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
锶(Sr)为第五周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2?6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物)制备高纯六水氯化锶的过程如下图: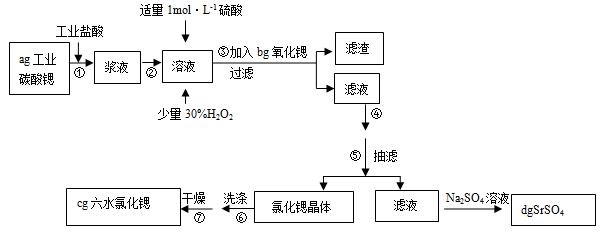
请回答:
(1)加入少量30%H2O2的作用 (用离子方程式表示);
(2)步骤③中氧化锶粉末的作用是 ,工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是 ;
(3)步骤④进行的实验操作为 、 ,步骤⑥中,洗涤氯化锶晶体最好选用 ;
| A.水 | B.硫酸 | C.氢氧化钠溶液 | D.氯化锶饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关实验装置进行的相应实验,能达到实验目的的是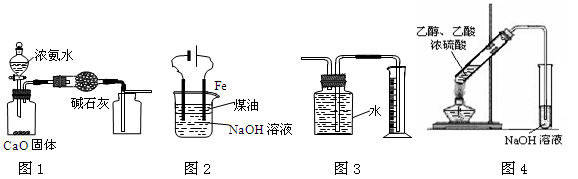
| A.用图1装置制取并收集干燥纯净的NH3 |
| B.用图2装置实验室制备Fe(OH)2 |
| C.装置3收集并测量Cu与浓硝酸反应产生的气体及体积 |
| D.装置4可用于实验室制取乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com