
【题目】某温度下,溶液中由水电离出氢离子的浓度为1×10-12mol·L-1,下列说法正确的是( )
A. 该溶液pH=12B. 该溶液pH=2
C. 该溶液pH=12或2D. 不能确定溶液pH
科目:高中化学 来源: 题型:
【题目】在下列各图曲线中分别表示物质的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),下列选项中的对应关系错误的是

A. 图①可以表示F-、Na+、Mg2+、Al3+四种离子的离子半径大小关系
B. 图②可以表示ⅡA族元素的最外层电子数
C. 图③可以表示ⅥA族元素氢化物的沸点高低关系
D. 图④可以表示第三周期中的非金属元素对应单质的熔点高低关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:有下列物质:①O2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩N2,回答下列问题:
(1)只含有极性键的是________;只含有非极性键的是________;含有极性键和非极性键的是________;只含有离子键的离子化合物是________;含有非极性键的离子化合物是________;
(2)写出⑤、⑧、⑨的电子式_____________、______________、________________;
(3)溶于水只破坏离子键的是__________;溶于水既破坏离子键又破坏共价键的是________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 金属钠着火使用泡沫灭火器灭火 B. 用湿润的KI淀粉试纸鉴别Br2(g)和NO2
C. 工业上利用合成氨实现人工固氮 D. 酸性氧化物均能与水反应生成对应的酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知外电路中,电子由铜流向a极。有关下图中装置分析合理的一项是( )
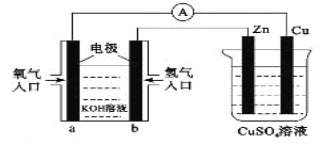
A. 一段时间后锌片质量减少
B. 该装之中Cu极为正极
C. b极的电极反应式:H2—2e—=2H+
D. 当铜片的质量变化为12.8g时,a极上消耗的O2在标况下的体积为2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】隔绝空气加热至500℃时硫酸亚铁铵[(NH4)2Fe(SO4)2]能完全分解,分解产物中含有铁 氧化物、硫氧化物、氨气和水蒸气等。
[实验探究]某化学小组选用下图所示部分装置进行分步实验(夹持装置略)。
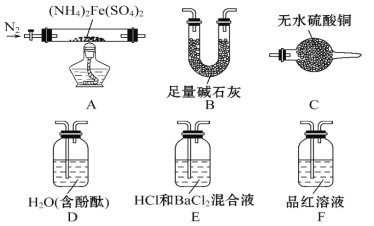
实验Ⅰ 甲同学为探究分解产物中的硫氧化物是 SO2 还是 SO3,连接装置A-E-F-B 进行实验。
(1)实验过程中观察到:E 中没有明显现象,F 中溶液褪色,据此得出的结论是 。
(2)B 的作用是_____。
实验Ⅱ 验证分解产物中含有水蒸气和氨气,并探究残留固体成分。
(3)所选用装置的正确连接顺序为_____(填装置的字母序号)。
(4)证明有水蒸气生成的实验现象为_____。
(5)证明有氨气生成的实验现象为_____。
(6)A 中固体完全分解后变为红棕色粉末,设计实验证明A 中残留固体中含有三价铁_______________。
(7)实验证明(NH4)2Fe(SO4)2 受热分解除上述产物外,还有N2 生成,写出A 中反应的化学方程式__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是一种用途广泛的精细化工产品。某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
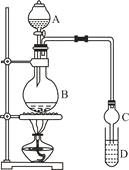
已知:①氯化钙可与乙醇形成CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
③2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
I.制备过程
装置如图所示,A中放有浓硫酸,B中放有9.5mL无水乙醇和6mL冰醋酸,D中放有饱和碳酸钠溶液。
(1)写出乙酸与乙醇发生酯化反应的化学方程式 。
(2)实验过程中滴加大约3mL浓硫酸,B的容积最合适的是 (填入正确选项前的字母)
A.25mL B.50mL C.250mL D.500mL
(3)球形干燥管的主要作用是 。
(4)预先向饱和Na2CO3溶液中滴加几滴酚酞试液,目的是
。
Ⅱ.提纯方法:①将D中混合液转入分液漏斗进行分液。
②有机层用5mL饱和食盐水洗涤,再用5mL饱和氯化钙溶液洗涤,最后用水洗涤。有机层倒入一干燥的烧瓶中,用无水硫酸镁干燥,得粗产物。
③将粗产物蒸馏,收集77.1℃的馏分,得到纯净干燥的乙酸乙酯。
(5)第①步分液时,选用的两种玻璃仪器的名称分别是 、 。
(6)第②步中用饱和食盐水、饱和氯化钙溶液、最后用水洗涤,分别主要洗去粗产品中的 , , 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:

(1)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:______________ 、________________;
(2)第③步中,生成氢氧化铝的离子方程式是_____________。若往A溶液中通入足量CO2,产生的沉淀为____________________(填化学式);
(3)工业上制取AlCl3常用Al2O3与C、Cl2在高温条件下反应,已知每消耗0.5mol碳单质,转移1mol电子,则该反应的氧化产物为_____________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com