
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| CH4O | C2H6O | C3H8O | C5H12O | C6H14O | … |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
分析 给予的分子符合饱和一元醇或饱和一元醚的通式,能和钠反应生成氢气的只有醇,所以这些物质都是饱和一元醇,饱和一元醇可以可作是支链烷烃中H原子被-OH取代的产物,所以可以根据烷基碳链结构判断饱和一元醇种类,据此分析解答.
解答 解:给予的分子符合饱和一元醇或饱和一元醚的通式,能和钠反应生成氢气的只有醇,所以这些物质都是饱和一元醇,饱和一元醇可以可作是支链烷烃中H原子被-OH取代的产物,所以可以根据烷基碳链结构判断饱和一元醇种类,根据表中数据知,阿拉伯数字序号与饱和一元醇中碳原子个数相等,所以4号位置分子式为C4H10O,烷基-C4H9有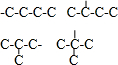 四种碳链结构,所以4号饱和一元醇有4种,故选B.
四种碳链结构,所以4号饱和一元醇有4种,故选B.
点评 本题考查探究化学规律,侧重考查学生分析判断及总结归纳能力,同分异构体类型有官能团异构、碳链异构、官能团位置异构等,题目难度不大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| 装置 | 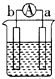 CuSO4溶液 |  稀硫酸 |  稀硫酸 |
| 现象 | a极质量减小 b极质量增大 | b极有气泡 c极无明显现象 | 电流从a极流向d极 |
| A. | d>a>b>c | B. | b>c>d>a | C. | a>b>c>d | D. | a>b>d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,将1molN2和3molH2混合,充分反应后转移的电子数为NA | |
| B. | 1.5molNO2与足量水反应,转移的电子数为1.5NA | |
| C. | 6.4g由S2、S4、S8组成的混合物含硫原子数为0.2NA | |
| D. | 常温常压下,11.2LCl2含氯原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下的33.6 L氯气与27 g铝充分反应,转移的电子数为3NA | |
| B. | 标准状况下,0.5 NA 个NO和0.5 NA 个O2混合气体的体积约为22.4 L | |
| C. | 一定条件下,将1 mol N2与3 mol H2混合反应后,生成NH3分子的数目为2NA | |
| D. | 在电解CuSO4溶液的实验中,测得电解后溶液pH=0,又知电解后溶液体积为1 L,在阳极析出的气体分子数约为0.25NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的离子积常数KW随着温度的升高而增大,说明水的电离过程是吸热的 | |
| B. | 弱电解质溶液稀释后,溶液中各种离子浓度一定都减小 | |
| C. | 某盐的水溶液呈酸性,该盐一定是强酸弱碱盐 | |
| D. | 中和相同体积相同pH的盐酸和醋酸溶液所需NaOH的物质的量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com