
| A. | 浓的强酸和稀的强碱反应 | B. | 浓的弱酸和稀的强碱反应 | ||
| C. | 等浓度的强酸和弱碱反应 | D. | 二元强酸与一元强碱反应 |
分析 一种c(H+)=1×10-3mol/L的酸和一种c(OH-)=1×10-3mol/L的碱溶液等体积混和后溶液呈酸性,说明反应后酸能继续电离H+,应为弱酸.
解答 解:A.浓的强酸和稀的强碱反应,强酸中氢原子浓度大于强碱溶液中氢氧根离子浓度,与题意不符合,故A错误;
B.浓的弱酸和稀的强碱反应,反应后酸剩余,所以溶液呈酸性,与题意符合,故B正确;
C.等浓度的强酸和弱碱反应,反应后碱剩余,所以溶液呈碱性,与题意不符合,故C错误;
D.二元强酸与一元强碱反应,反应刚好反应完全,则溶液呈中性,与题意不符合,故D错误;
故选B.
点评 本题考查酸碱混合时的定性判断及有关pH的计算,题目难度不大,注意根据n(H+)与n(OH-)关系以及反应后溶液的酸碱性判断酸碱的强弱关系.


科目:高中化学 来源: 题型:选择题
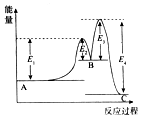 反应A→C分两步进行:①A→B,②B→C.反应过程能量变化曲线如图所示(E1、E2、E3、E4表示活化能).下列说法正确的是( )
反应A→C分两步进行:①A→B,②B→C.反应过程能量变化曲线如图所示(E1、E2、E3、E4表示活化能).下列说法正确的是( )| A. | 两步反应的△H均大于0 | B. | 加入催化剂能改变反应的焓变 | ||
| C. | 三种物质中C最稳定 | D. | A→C反应的△H=E4-E1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入BaCl2溶液,有白色沉淀,则原溶液一定存在Ag+或SO42- | |
| B. | 向某溶液中加入足量的盐酸,放出二氧化碳气体,可证明该溶液中一定含有CO32- | |
| C. | 用洁净铁丝蘸取溶液进行焰色反应,火焰呈黄色,则原溶液中有Na+ | |
| D. | 向某溶液滴加NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,可确定原溶液中无NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 寻找合适催化剂提高合成氨工业中原料的转化率 | |
| B. | 对废旧电池进行回收处理,主要是为了环境保护和变废为宝 | |
| C. | 提高油品质量,可以从一定程度上减少雾霾天气 | |
| D. | 含重金属离子的电镀废液不能随意排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LO3和O2的混合气体含有的分子数目为NA | |
| B. | 标准状况下,22.4 LCCl4所含原子数目为5 NA | |
| C. | 2 mo l/LMg Cl2溶液中含Cl-数目为4NA | |
| D. | 9 g D2O中所含电子数目为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 | B. | Na2CO3+CO2+H2O═2NaHCO3 | ||
| C. | 3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4 | D. | NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应(1)和(2)均为氧化还原反应 | |
| B. | 反应(1)的氧化剂是O2,还原剂是FeO•Cr2O3 | |
| C. | 高温下,O2的氧化性大于Fe2O3小于Na2CrO4 | |
| D. | 生成1mol的Na2Cr2O7时共转移5mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4、C4H6 | B. | C2H2、C4H8 | C. | C3H4、C4H8 | D. | C3H4、C3H6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com