

| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
分析 (1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也进行相应的运算;
(2)①CH3OCH3的体积分数随投料比[$\frac{n({H}_{2})}{n(C{O}_{2})}$]的增大而增大,当体积比是3的时候,甲醚的体积分数最大,由极限法可知,投料比无限增大,虽然二氧化碳的转化率增大,但混合气体总体积无限大,而二甲醚的体积无限接近二氧化碳的一半,二甲醚的体积分数减小;
②由图3可知,温度一定时,平衡时二甲醚的物质的量分数:P1>P2>P3>P4,而该反应正反应为气体体积减小的反应,增大压强平衡向正反应方向移动,二甲醚的物质的量分数增大;
由图1可知,投料比[$\frac{n({H}_{2})}{n(C{O}_{2})}$]一定时,温度越高,平衡时二氧化碳的转化率越高,说明升高温度,平衡向逆反应方向移动,而压强一定时,平衡时二甲醚的物质的量分数:T1<T2<T3<T4;
(3)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向,逆反应方向移动;
设CO的浓度变化量为xmol/L,用三段式表示出平衡时各组分物质的,再根据平衡常数列方程计算解答.
解答 解:(1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
根据盖斯定律,③-①×2+②得:CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162 kJ•mol-1,
故答案为:CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162 kJ•mol-1;
(2)①CH3OCH3的体积分数随投料比[$\frac{n({H}_{2})}{n(C{O}_{2})}$]的增大而增大,当体积比是3的时候,甲醚的体积分数最大,由极限法可知,投料比无限增大,虽然二氧化碳的转化率增大,但混合气体总体积无限大,而二甲醚的体积无限接近二氧化碳的一半,二甲醚的体积分数减小,故二甲醚的体积分数与投料比的关系为: ,故答案为:
,故答案为: ;
;
②由图3可知,温度一定时,平衡时二甲醚的物质的量分数:P1>P2>P3>P4,而该反应正反应为气体体积减小的反应,增大压强平衡向正反应方向移动,二甲醚的物质的量分数增大,故压强:P1>P2>P3>P4;
由图1可知,投料比[$\frac{n({H}_{2})}{n(C{O}_{2})}$]一定时,温度越高,平衡时二氧化碳的转化率越高,说明升高温度,平衡向逆反应方向移动,二甲醚的物质的量分数减小,而压强一定时,平衡时二甲醚的物质的量分数:T1<T2<T3<T4,故温度:T1>T2>T3>T4,
故选:BD;
(3)反应:CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数表达式K=$\frac{c({H}_{2})×(C{O}_{2})}{c(CO)×c({H}_{2}O)}$;
由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向,逆反应方向移动,则正反应为放热反应;
设CO的浓度变化量为xmol/L,则:
CO(g)+H2O(g)?H2(g)+CO2(g)
开始(mol/L):0.02 0.02 0 0
转化(mol/L):x x x x
平衡(mol/L):0.02-x 0.02-x x x
则$\frac{x×x}{(0.02-x)×(0.02-x)}$=9,解得x=0.015,
故CO的转化率为$\frac{0.015mol/L}{0.02mol/L}$×100%=75%,
故答案为:$\frac{c({H}_{2})×(C{O}_{2})}{c(CO)×c({H}_{2}O)}$;放热;75%.
点评 本题考查热化学方程式书写、化学平衡图象及影响因素、化学平衡计算等,(2)中作图为易错点,注意利用极限法判断二甲醚的体积分数变化情况,注意平衡常数在化学计算中的应用.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的电子式  | B. | 氯化钠的分子式 NaCl | ||
| C. | 硫原子的最外层电子排布式3s23p4 | D. | 钠离子的结构示意图 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚能和NaOH溶液反应 | |
| B. | 甲苯与液溴,铁作催化剂的反应 | |
| C. | 甲苯能被酸性高锰酸钾氧化 | |
| D. | 1mol邻二甲苯与3mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 洗涤烧杯和玻璃棒的溶液未转入容量瓶中 | |
| C. | 定容时观察液面俯视 | |
| D. | 定容加水超过刻度线又吸出少量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
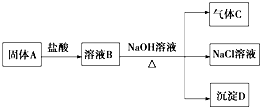
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
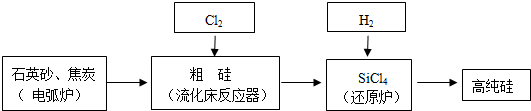
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
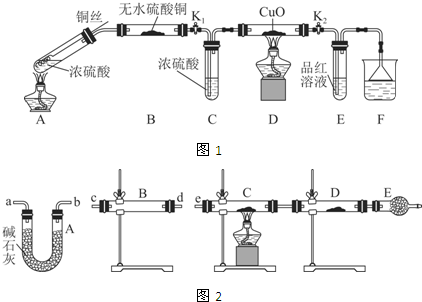
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | ① | ② | ③ |
| C | CuO固体 | ④ | ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 化学镀铜废液中含有一定量的CuS04,任意排放会污染环境,利用电化学原理可对废液进行回收处理,装置如图,其中质子交换膜只允许H+通过.
化学镀铜废液中含有一定量的CuS04,任意排放会污染环境,利用电化学原理可对废液进行回收处理,装置如图,其中质子交换膜只允许H+通过.| A. | 反应之前,应将含OH-的HCHO溶液加人到装置的左侧 | |
| B. | 右侧发生的电极反应式:HCH0-2e-+H20=HC0O-+3H+ | |
| C. | 若将质子交换膜换成阴离子交换膜,放电过程中,大量的OH-将向左侧迁移 | |
| D. | 放电一段时间后打开开关,移去质子交换膜,装置中可能会有红色固体、蓝色絮状物出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氯丙烷有三种同分异构体 | |
| B. | 碳酸氢钠可用作食品加工中的无铝发泡剂,快速发酵粉 | |
| C. | 二氧化碳制全降解塑料有助于控制温室效应和白色污染 | |
| D. | 某化合物的分子式为C8H10O,其中能与乙酸发生酯化反应的同分异构体有4种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com