


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
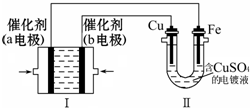 如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),电池总反应为:CH4+2O2+2KOH=K2CO3+3H2O,通过装置Ⅱ实现铁棒上镀铜.下列说法正确的是( )
如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),电池总反应为:CH4+2O2+2KOH=K2CO3+3H2O,通过装置Ⅱ实现铁棒上镀铜.下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 Cu(OH)2+2H+
Cu(OH)2+2H+ Cu(OH)2+2H+
Cu(OH)2+2H+
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com