
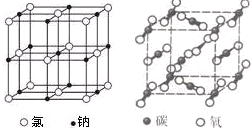
 如图是氯化钠晶体和二氧化碳晶体的结构示意图关于两种晶体说法正确的是( )
如图是氯化钠晶体和二氧化碳晶体的结构示意图关于两种晶体说法正确的是( )| A、两种晶体均以分子间作用力按一定规则排列组成 | B、两者的硬度、熔沸点等物理性质与微粒间的作用力都有密切关系 | C、构成两种晶体的微粒均是原子 | D、两种晶体均属于离子晶体 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 、④HCHO等,其中碳原子采取sp2杂化的分子有
、④HCHO等,其中碳原子采取sp2杂化的分子有


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
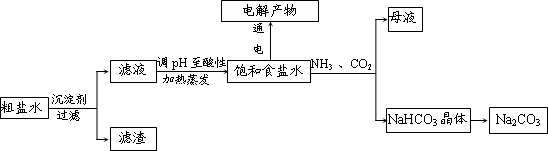
| ||
| ||
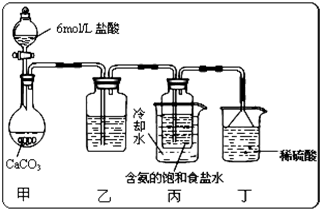
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
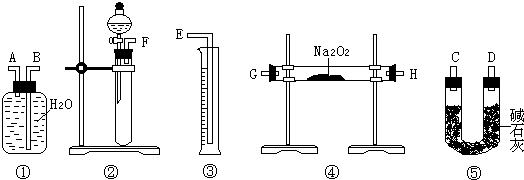
查看答案和解析>>
科目:高中化学 来源: 题型:
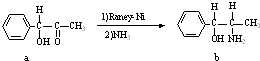
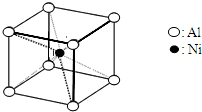
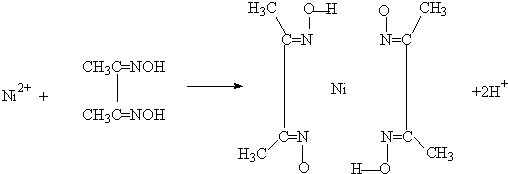
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com