
【题目】将充满二氧化氮和氧气的混合气体的量筒倒置于水中,充分反应后,保持气体压强不变,水进入至量筒体积的一半处停止了,则原混合气体中二氧化氮和氧气的体积比是多少?_________________
【答案】2∶3
【解析】
设混合气体的体积为V,则反应后剩余气体体积为![]() ,NO2和O2混合气体与反应可能的反应式有:4NO2+O2+2H2O=4HNO3、3NO2+H2O=2HNO3+NO,根据反应的方程式用讨论的方法计算。
,NO2和O2混合气体与反应可能的反应式有:4NO2+O2+2H2O=4HNO3、3NO2+H2O=2HNO3+NO,根据反应的方程式用讨论的方法计算。
设混合气体的体积为V,则反应后剩余气体体积为![]() ,
,
①如果氧气过量,则剩余![]() ,气体为氧气,参加反应的气体体积为
,气体为氧气,参加反应的气体体积为![]() ,根据反应4NO2+O2+2H2O=4HNO3可知,混合气体中含有二氧化氮的体积为
,根据反应4NO2+O2+2H2O=4HNO3可知,混合气体中含有二氧化氮的体积为![]() ×
×![]() =
=![]() ,则原混合气体中NO2和O2的体积比V(NO2):V(O2)=
,则原混合气体中NO2和O2的体积比V(NO2):V(O2)=![]() :
:![]() =2:3;
=2:3;
②如果NO2过量,则剩余![]() ,气体为NO,根据反应3NO2+H2O=2HNO3+NO可知,剩余的二氧化氮的体积为:
,气体为NO,根据反应3NO2+H2O=2HNO3+NO可知,剩余的二氧化氮的体积为:![]() ×3=1.5V,不符合混合气体总体积为V。故原混合气体中NO2和O2的体积比2:3。
×3=1.5V,不符合混合气体总体积为V。故原混合气体中NO2和O2的体积比2:3。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】(任务一)探究墨粉中铁的氧化物。墨粉是由树脂和炭黑、电荷剂、磁粉(铁氧化物)等组成。
(1)向一定量墨粉中加入适量的稀硫酸充分振荡后,向试管中缓缓压入棉花团至试管底部,棉花团所起的作用是___________。
(2)取(1)中水层部分清液,把清液分装两试管,一试管中加入适量![]() 溶液,出现_________,证明有Fe3+,另一试管中加入铁氰化钾溶液,立即出现______,证明有Fe2+。
溶液,出现_________,证明有Fe3+,另一试管中加入铁氰化钾溶液,立即出现______,证明有Fe2+。
(任务二)设计实验方案,测定墨粉中铁元素的质量分数。取![]() 墨粉经过一系列操作,配制成
墨粉经过一系列操作,配制成![]() 溶液(溶液中铁元素全部转化为Fe3+),取出
溶液(溶液中铁元素全部转化为Fe3+),取出![]() 溶液,用
溶液,用![]() 的
的![]() 溶液滴定。
溶液滴定。
(1)滴定过程中,选择的指示剂是______。
a.淀粉溶液 b. ![]() 溶液 c.
溶液 c.![]() 溶液 d.
溶液 d.![]() 溶液
溶液
(2)若滴定过程中消耗![]() 溶液
溶液![]() ,则墨粉中铁的质量分数为______(百分数保留两位整数)。
,则墨粉中铁的质量分数为______(百分数保留两位整数)。
(任务三)了解![]() 的工业制备。复印机使用的墨粉的主要成分是
的工业制备。复印机使用的墨粉的主要成分是![]() ,如图是利用硫铁矿烧渣制备高纯
,如图是利用硫铁矿烧渣制备高纯![]() 的工艺流程。
的工艺流程。

已知:
①![]() ;
;
②![]() 在水中可溶,在乙醇中难溶;
在水中可溶,在乙醇中难溶;
③![]() 在乙醇与水的混合溶剂中的溶解度随乙醇体积分数的变化曲线如图所示:
在乙醇与水的混合溶剂中的溶解度随乙醇体积分数的变化曲线如图所示:

回答下列问题:
(1)①浸出液中含有的金属阳离子为______________,操作②中加入铁屑的目的是_________。
(2)步骤③用![]() 作氧化剂的优点是_______。
作氧化剂的优点是_______。
(3)经步骤⑤后,一般需要对所得晶体进行洗涤和干燥处理。请说出选择乙醇和水的混合液作为洗涤液的理由___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、科技及环境密切相关。下列说法正确的是( )
A.2020年3月9日,发射了北斗系统第五十四颗导航卫星,其计算机的芯片材料是一种有机高分子材料
B.白葡萄酒含维生素C等多种维生素,通常添加微量![]() 的目的是防止营养成分被氧化
的目的是防止营养成分被氧化
C.酒精与84消毒液混合,可增强杀灭新型冠状病毒效果
D.聚合硫酸铁![]() ,是新型絮凝剂,可用来杀灭水中病菌
,是新型絮凝剂,可用来杀灭水中病菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是( )
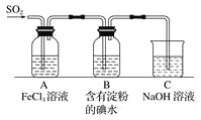
A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
D.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年2月27日至3月1日,第十届日本国际二次电池展在日本东京举行,各种新型二次电池在东京有明展览中心展出,其中以![]() 为代表的新型可充电钠离子电池,格外引人注意,其放电工作原理如图所示。下列说法正确的是( )
为代表的新型可充电钠离子电池,格外引人注意,其放电工作原理如图所示。下列说法正确的是( )

A.放电时,正极反应式为:![]()
B.放电时,电子自Mg箔流出,经含Na+的电解质流向Mo箔
C.充电时,Na+通过离子交换膜从右室移向左室
D.充电时,Mo箔接电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,H2SO3的电离常数Ka1=1.23![]() 10-2,Ka2=5.6
10-2,Ka2=5.6![]() 10-8,HClO的电离常数Ka=2.98
10-8,HClO的电离常数Ka=2.98![]() 10-8,下列说法错误的是
10-8,下列说法错误的是
A.常温下,相同浓度的H2SO3 比HClO酸性强
B.常温下,将NaHSO3溶液滴入到NaClO溶液中不发生化学反应
C.常温下,NaHSO3溶液中HSO3-的电离程度大于其水解程度,NaHSO3溶液呈酸性
D.将pH=5的HClO溶液加水稀释到pH=6时,溶液中部分离子浓度会升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、S、P等元素常用于化工材料的合成。回答下列问题:
、S、P等元素常用于化工材料的合成。回答下列问题:
(1)钴原子的基态电子排布式为_______________________。
(2)![]() 有________几种不同的运动状态的电子,
有________几种不同的运动状态的电子,![]() 比
比![]() 更稳定的原因是_________。
更稳定的原因是_________。
(3)硒为第四周期元素,相邻元素有砷和溴,则三种元素的电负性从大到小的顺序为_________(用元素符号表示)。
(4)![]() 的熔点为340℃,加热易升华,固体
的熔点为340℃,加热易升华,固体![]() 属于______晶体。
属于______晶体。![]() 的空间构型为_____。
的空间构型为_____。
(5) ![]() 可用于制造火柴,其分子结构如图甲所示。
可用于制造火柴,其分子结构如图甲所示。![]() 分子中S的杂化方式为______。每个
分子中S的杂化方式为______。每个![]() 分子中含有的孤电子对的数目为_________。
分子中含有的孤电子对的数目为_________。


(6)铜的某种氧化物晶胞结构如图乙所示,该氧化物的化学式为____________。若该晶胞的边长为![]() ,阿伏加德罗常数值为
,阿伏加德罗常数值为![]() ,则该氧化物的密度为_________
,则该氧化物的密度为_________![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)写出图1中序号①~④仪器的名称:①__;②__;③__;④__。在仪器①~④中,使用前必须检查是否漏水的有__(填仪器序号)。
(2)图2是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上(密度1.84 g·cm-3,质量分数98%)的部分内容,现用该浓硫酸配制480 mL 1 mol·L﹣1的稀硫酸。可供选用的仪器有:
①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
a.图3中盛放浓硫酸的试剂瓶标签上应该印有图警示标记中的__(写标记代号A~D)。
b.配制稀硫酸时,除了上述仪器,还缺少的仪器有__、__(写仪器名称)。
c.经计算,配制480 mL 1 mol·L-1的稀硫酸,需要用量筒量取上述浓硫酸的体积为__mL(保留一位小数点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数,下列有关说法正确的是( )
为阿伏加德罗常数,下列有关说法正确的是( )
A.![]() 的
的![]() 溶液中
溶液中![]() 和
和![]() 离子数之和为
离子数之和为![]()
B.常温下,![]() 的
的![]() 溶液中,发生电离的水分子数为
溶液中,发生电离的水分子数为![]()
C.氢氧燃料电池负极消耗![]() 气体时,电路中转移的电子数为
气体时,电路中转移的电子数为![]()
D.用情性电极电解![]() 溶液后,如果加入
溶液后,如果加入![]() 能使溶液复原,则电路中转移的电子数为
能使溶液复原,则电路中转移的电子数为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com