
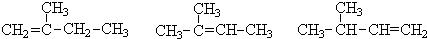
分析 (1)A、B、C三种烃均为烯烃,烯烃的命名中,选项含有碳碳双键的最长碳链为主链,编号从距离双键最近的一端开始,命名中必须最长碳碳双键的物质,据此完成本题;
(2)根据主链减碳作为取代基进行书写烷烃的异构体,根据有机物的命名原则进行命名:取含有取代基最多且最长的链为主链,称某烷,指明取代基的位置与数目,据此解答.
解答 解:(1)烯烃A中,主链为丁烯,编号从左边开始,在2号C有1个甲基,双键在1号C,A的命名为2-甲基-1-丁烯;
烯烃B主链为丁烯,编号从左边开始,在2号C有1个甲基,碳碳双键在2号C,命名为:2-甲基-2-丁烯;
C主链为丁烯,编号从右边开始,在3号C上有1个甲基,碳碳双键在1号C,C的命名为:3-甲基-1-丁烯;
故答案为:3-甲基-1-丁烯;
(2)丁烷(C4H10)的同分异构体:CH3CH2CH2CH3 (丁烷);CH3CH(CH3)2 (2-甲基丙烷);
戊烷(C5H12)的同分异构体:CH3CH2CH2CH2CH3 (戊烷);CH3CH2CH(CH3)2 (2-甲基丁烷);C(CH3)4(2,2-二甲基丙烷);
答:CH3CH2CH2CH3 (丁烷)、CH3CH(CH3)2 (2-甲基丙烷);CH3CH2CH2CH2CH3 (戊烷)、CH3CH2CH(CH3)2 (2-甲基丁烷)、C(CH3)4(2,2-二甲基丙烷).
点评 本题考查了烯烃的命名,题目难度不大,注意熟练掌握常见有机物的系统命名原则,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 | |
| B. | 溴乙烷(乙醇):多次加水振荡,分液,弃水层 | |
| C. | 苯(苯酚):加溴水,振荡,过滤除去沉淀 | |
| D. | 溴苯(溴):加稀氢氧化钠溶液充分振荡洗涤后分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
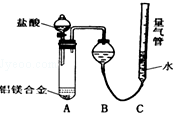 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定已知质量的铝镁合金(设不含其它元素)中镁的质量分数,设计下列三种不同实验方案(所加试剂均为足量)进行探究.填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定已知质量的铝镁合金(设不含其它元素)中镁的质量分数,设计下列三种不同实验方案(所加试剂均为足量)进行探究.填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 6 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
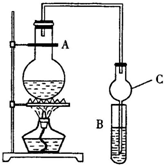 某课外活动小组设计的实验室制取较多量乙酸乙酯的装置如图所示,A中放有乙醇、无水醋酸钠和浓硫酸,B中放有饱和碳酸钠溶液(已知①无水CaCl2可与乙醇形成难溶于的CaCl2•6C2H5OH;②有关有机物的沸点,乙醚:34.7℃;乙醇:78.5℃;乙酸乙酯77.1℃),试回答:
某课外活动小组设计的实验室制取较多量乙酸乙酯的装置如图所示,A中放有乙醇、无水醋酸钠和浓硫酸,B中放有饱和碳酸钠溶液(已知①无水CaCl2可与乙醇形成难溶于的CaCl2•6C2H5OH;②有关有机物的沸点,乙醚:34.7℃;乙醇:78.5℃;乙酸乙酯77.1℃),试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
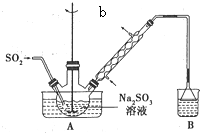 次硫酸氢钠甲醛(aNaHSO2•bHCHO•cH2O)俗称吊白块,有较强的还原性.它常温下比较稳定,在120℃以上分解成亚硝酸盐.以Na2SO3、SO2、HCHO和锌粉为原料可制备次硫酸氢钠甲醛.实验步骤如下:
次硫酸氢钠甲醛(aNaHSO2•bHCHO•cH2O)俗称吊白块,有较强的还原性.它常温下比较稳定,在120℃以上分解成亚硝酸盐.以Na2SO3、SO2、HCHO和锌粉为原料可制备次硫酸氢钠甲醛.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对农作物合理施用化肥 | B. | 对废旧电池进行回收处理 | ||
| C. | 将塑料垃圾埋入地下或者倾倒入海 | D. | 使用沼气、太阳能、风能等代替煤炭 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com