
请回忆食盐晶体的晶胞结构,已知食盐密度为ρ g·cm-3,摩尔质量为M g·mol-1,阿伏加德罗常数为NA,则在食盐晶体中Na+和Cl-的核间距大约是( )
A.  cm B.
cm B. 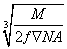 C.
C. 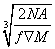 cm D.
cm D.  cm
cm
科目:高中化学 来源: 题型:
1.92gCu片与一定量的浓HNO3作用,当收集到NO2和NO气体共1.12L时(标准状况),金属铜恰好全部作用。则:
⑴反应中消耗HNO3______mol,转移电子______mol。
⑵用排水法收集生成的气体,最后气体的体积为 L (标况)
⑶ 向收集到的气体中通入 ml O2(标况)才能使水刚好充满整个集气容器.
查看答案和解析>>
科目:高中化学 来源: 题型:
根据化学变化的实质是旧的化学键断裂、新的化学键形成这一理论,判断下列变化是化学变化的是
A.固体氯化钠溶于水 B.氯化铵受热分解生成氯化氢和氨气
C.冰经加热变成水蒸气 D.氯化氢溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
A.在NH4+和[Cu(NH3)4]2+中都存在配位键
B.C2H5OH与C2H5Br相比,前者的沸点远高于后者,其原因是前者的分子间存在氢键
C.同周期ⅠA族元素和 ⅦA族元素之间只能形成离子化合物
D.由两种非金属元素组成的化合物分子中只可能有极性键,不会有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是原子序数依次增大的短周期主族元素,X、Z在周期表中的相对位置如下表。已知X元素最低负化合价的绝对值与其原子最外层电子数相等,Y是地壳中含量最多的金属元素。下列说法错误的是( )
| X | ||
| Z |
A.X位于第二周期第IVA族
B.原子半径由小到大的顺序为:W<Z<Y
C.Z、W两元素的气态氢化物中,Z的气态氢化物更稳定
D.无论氧气是否过量,Z在氧气中燃烧的产物唯一
查看答案和解析>>
科目:高中化学 来源: 题型:
S2Cl2是广泛用于橡胶工业的硫化剂,常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,其结构与H2O2类似。下列说法错误的是( )
A.S2Cl2分子中的两个S原子均是sp3杂化
B.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
C.S2Br2与S2Cl2结构相似,熔沸点S2Br2>S2Cl2
D.S2Cl2分子中的S为-1价,既含有极性键又含有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实及其解释不正确的是 ( )。
A.滴有酚酞的NaHCO3溶液呈浅红色,微热后红色加深,是因为NaHCO3分解生成了Na2CO3
B.钠保存在煤油中,是因为煤油不与钠发生反应,钠比煤油密度大,煤油可以使钠隔绝空气和水蒸气
C.用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO 2、H2O与Na2O2的反应是放热反应
2、H2O与Na2O2的反应是放热反应
D.钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O与水和二氧化碳反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是________。
(2)混合 气体的平均摩尔质量是________。
气体的平均摩尔质量是________。
(3)CO2和CO的体积之比是________。
(4)CO的体积分数是________。
(5)CO2和CO的质量之比是________。
(6)CO的质量分数是________。
(7)混合气体中所含氧原子的物质的量是________。
(8)混合气体中所含碳原子的物质的量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如下图所示。
(1)由图中的数据分析,该反应的化学方程式为 ;
(2)反应开始至2min时Z的平均反应速率为 ;
(3)下列关于化学反应速率与化学反应限度的叙述不正确的是 ( )
A.反应限度是一种平衡状态,此时反应已经停止
B.达到平衡状态时,正反应速率和逆反应速率相等
C.达到平衡状态时,反应物和生成物浓度都不再改变
D.化学反应速率理论是研究怎样在一定时间内快出产品
E. 化学平衡理论是研究怎样使用有限原料多出产品
(4)5min后曲线的含义 ;

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com