
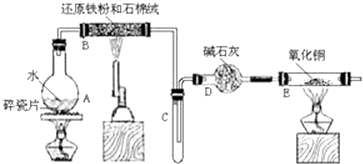
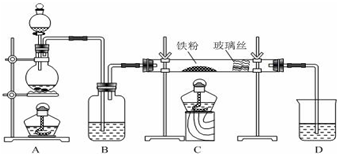
���� A��Բ����ƿ�ڼ��������¿��ṩˮ������B�ڼ��������£�����ˮ������Ӧ����������������������DΪ����װ�ã�E�����ɵ�����������ͭ�ڼ��������·�Ӧ����ͭ��ˮ������KSCN���������ӣ������ܶȱȿ���С�����÷���Һ�����������Դ˽����⣮
��� �⣺��1��װ��B��������ˮ�����ڸ����·�����Ӧ������������������������Ӧ�Ļ�ѧ����ʽΪ��3Fe+4H2O��g��$\frac{\underline{\;\;��\;\;}}{\;}$Fe3O4+4H2��
�ʴ�Ϊ��3Fe+4H2O��g��$\frac{\underline{\;\;��\;\;}}{\;}$Fe3O4+4H2��
��2��װ��B����ˮ������Ӧ���ɵ�����������ʯ�Ҹ�������װ��E�����������������ȷ�����Ӧ����������ˮ�����Է�Ӧ������Ϊ����ɫ�ķ�ĩ��ɺ�ɫ���ܱڲ���ˮ�飬
�ʴ�Ϊ����ɫ�ķ�ĩ��ɺ�ɫ���ܱڲ���ˮ�飻
��3���������������ӵķ���Ϊ��ȡ������Һ�����뼸�����軯����Һ���۲���Һ�Ƿ���ɫ��
�ʴ�Ϊ��ȡ������Һ���Թ��У����뼸��KSCN��Һ���۲���Һ�Ƿ���ɫ��
��4�������ܶȱȿ���С�����÷���Һ�����������۲��Ƿ��з��������ɣ��ʴ�Ϊ���������Һ�й۲��Ƿ��з��������ɣ�
���� ���⿼���������仯���������ʵ�飬��Ŀ�ѶȲ���ע����������ˮ������Ӧԭ����������ض�ѧ��������������ѵ��������������ѧ���淶�Ͻ���ʵ����ơ�����������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ͭ������ | B�� | п������ | ||
| C�� | ������ͭ����������п | D�� | пƬ�ϵķ�ӦΪ��Zn-2e-=Zn2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | AgCl | B�� | �������Һ | C�� | NH3 | D�� | ������̼ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ij̽��С�������ͼ��ʾװ�ý���Fe����ˮ�����ķ�Ӧ��
ij̽��С�������ͼ��ʾװ�ý���Fe����ˮ�����ķ�Ӧ��| ���� | ���� | �������� | �������� |
| 1 | ȡ��ɫ��ĩ����ϡ���� | �ܽ⣬������ | �ܽ⣬������ |
| 2 | ȡ����1����Һ���μ�����KMnO4��Һ | ��ɫ��ȥ | ��ɫ��ȥ |
| 3 | ȡ����1����Һ���μ�KSCN��Һ | ��� | ������ |
| 4 | ����3��Һ�еμ�������ˮ | ��ɫ��ȥ | �ȱ�죬����ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������������Ҫ���л��ij��ѧ��ȤС���������������ȡ����̽�����
������������Ҫ���л��ij��ѧ��ȤС���������������ȡ����̽������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ʵ������������ͼ��ʾ��װ����ȡ�����������ش��������⣺
��ʵ������������ͼ��ʾ��װ����ȡ�����������ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �����ճ���������;��㡢�������Ľ������ϣ�
�����ճ���������;��㡢�������Ľ������ϣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com