
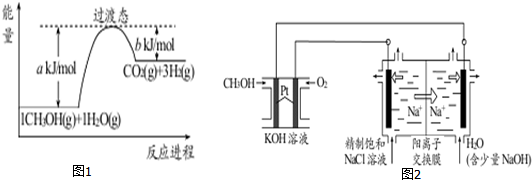
分析 (1)催化剂降低反应的活化能,加快反应速率,即a减小,但催化剂不能改变活化能,即反应热△H不变.根据图象可知反应热=akJ/mol-bkJ/mol,所以CH3OH(g)和H2O(g)反应的热化学方程式为CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a-b)kJ/mol.
(2)以CH3OH燃料电池为电源电解法制取ClO2,二氧化氯(ClO2)为一种黄绿色气体,通入O2的电极是正极,负极甲醇失去电子在碱溶液中生成碳酸盐,
①CH3OH燃料电池放电过程中,通入O2的电极是正极,氧气得到电子转化为氢氧根,则附近溶液的pH增大,负极甲醇失去电子在碱溶液中生成碳酸盐;
②电解池中阳极失去电子,则阳极氯离子放电,产生ClO2,结合电子守恒和电荷守恒配平书写;
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),多出的气体是氢气,物质的量是0.3mol.设阳极产生的气体是xmol,则根据电子得失守恒可知5x=(0.3+x)×2,解得x=0.2,即转移1mol电子,钠离子通过阳离子交换膜,所以通过阳离子交换膜的阳离子为1mol;
(3)电解CuSO4溶液质量增重的一极是电解池的阴极,析出铜,同时会产生氢气,电解方程式为:2CuSO4+2H20$\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑,也可根据电解池两极上转移的电子数目相等计算,利用反应式来计算pH,根据电解方程式计算.
解答 解:(1)催化剂降低反应的活化能,加快反应速率,即a减小,但催化剂不能改变活化能,即反应热△H不变,反应能量图中生成物的总能量大于反应物的总能量,则为吸热反应,由图可知,1mol 甲醇和1mol 水蒸气反应生成CO2和氢气吸收的热量为(a-b)kJ,反应热化学方程式为:CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a-b)kJ/mol,
故答案为:减小;不变;CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a-b)kJ/mol;
(2)①CH3OH燃料电池放电过程中,通入O2的电极是正极,氧气得到电子转化为氢氧根,则附近溶液的pH增大,
故答案为:增大;
②电解池中阳极失去电子,则阳极氯离子放电,产生ClO2的反应式为:Cl--5e-+2H2O=4H++ClO2↑,
故答案为:Cl--5e-+2H2O=4H++ClO2↑;
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),多出的气体是氢气,物质的量=$\frac{6.72L}{22.4L/mol}$=0.3mol,设阳极产生的气体是xmol,则根据电子得失守恒可知5x=(0.3+x)×2,解得x=0.2,即转移1mol电子,钠离子通过阳离子交换膜,所以通过阳离子交换膜的阳离子为1mol,
故答案为:1;
(3)①电解总反应式为2CuSO4+2H20$\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑,故答案为:2CuSO4+2H20$\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑;
②电解硫酸铜溶液0.01mol,阴极上发生反应:Cu2++2e-═Cu,2H++2e-═H2↑,0.01mol铜离子得电子转移0.02mol电子,若产生224mL即0.01mol气体,转移电子是0.022mol,共0.04mol电子转移,阳极上发生反应4OH--4e-═2H2O+O2↑,产生相同气体,若为224mL即0.01mol气体,转移电子的物质的量是0.04mol,根据反应式:2CuSO4+2H20$\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑,当生成0.01mol铜,生成硫酸是0.01mol,所以氢离子浓度是$\frac{0.01mol×2}{0.2L}$=0.1mol/L,所以pH=1;故答案为:1;
③电解过程中少什么加什么,少多少加多少,根反应式:阴极上发生反应:Cu2++2e-═Cu,2H++2e-═H2↑,阳极上发生反应4OH--4e-═2H2O+O2↑,析出了铜,跑掉了氧气和氢气,故选B.
点评 本题主要是考查反应热的计算、盖斯定律应用及电化学原理的应用,注意原电池和电解池的原理分析和电极反应书写,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试管1 | 试管2 | |
| 实验现象 | 褪色很快 | 褪色很慢 |
| 褪色时间/s | 4秒 | 31秒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ,写出另一种盐的电子式
,写出另一种盐的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2+CuO═Cu+H2O | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | H2+Cl2═2HCl | D. | 2NaOH+Cl2═NaCl+NaClO+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH2PO4溶液PH<7,则在溶液中:c(Na+)>c(H2PO4-)>c(H3PO4)>c(HPO42-) | |
| B. | 0.1mol•L-1(NH4)2SO4溶液与0.1mol•L-1NH3•H2O溶液等体积混合:c(NH4+)+c(H+)=2c(SO42-)+c(OH-) | |
| C. | 0.1mol•L-1CH3COONa溶液与0.1mol•L-1CH3COOH溶液等体积混合(pH<7)c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+) | |
| D. | 0.2mol•L-1NaHCO3溶液与0.1mol•L-1Na2CO3溶液等体积混合:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知火箭所用燃料为肼(N2H4),氧化剂为过氧化氢,火箭部分构件采用钛合金材料.请回答下列问题:
已知火箭所用燃料为肼(N2H4),氧化剂为过氧化氢,火箭部分构件采用钛合金材料.请回答下列问题:| 物质 | 熔点/K | 沸点/K | 水中溶解度(标准状况) |
| H2S | 187 | 202 | 每升水中溶解2.6L |
| H2O2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com