
| 酸 | 电离常数 |
| 碳酸 | K1=4×10-7 K2=5.6×10-11 |
| 亚硫酸 | K1=1.54×10-2 K2=1.02×10-7 |
| A. | SO2+H2O+2CO32-=2HCO3-+SO32- | B. | SO2+2HCO3-=2CO2+SO32-+H2O | ||
| C. | 2SO2+H2O+CO32-=CO2+2HSO3- | D. | SO2+H2O+CO32-=HCO3-+HSO3- |
分析 碳酸存在电离平衡H2CO3?HCO3-+H+,K1=4×10-7,HCO3-?H++CO32- K2=5.6×10-11,
亚硫酸存在电离平衡 H2SO3?HSO3-+H+,K1=1.54×10-2,HSO3-?H++SO32- K2=1.02×10-7,
碳酸与亚硫酸都是弱酸,电离平衡常数越大,酸性越强,酸性强弱为:H2SO3>H2CO3>HSO3->HCO3-,发生化学反应应遵循强酸制备弱酸的原理,据此分析解答.
解答 解:碳酸存在电离平衡H2CO3?HCO3-+H+,K1=4×10-7,HCO3-?H++CO32- K2=5.6×10-11,
亚硫酸存在电离平衡 H2SO3?HSO3-+H+,K1=1.54×10-2,HSO3-?H++SO32- K2=1.02×10-7,
碳酸与亚硫酸都是弱酸,电离平衡常数越大,酸性越强,酸性强弱为:H2SO3>H2CO3>HSO3->HCO3-,发生化学反应应遵循强酸制备弱酸的原理,
A.酸性H2SO3>HCO3-,反应SO2+H2O+2CO32-=2HCO3-+SO32-符合强酸制弱酸,故A不选;
B.酸性H2CO3>HSO3-,反应生成HSO3-,正确的离子方程式为:SO2+HCO3-=CO2+HSO3-,故B选;
C.根据B可知,该离子方程式合理,故C不选;
D.酸性H2SO3>H2CO3>HSO3->HCO3-,二氧化硫与碳酸根离子反应生成HCO3、和HSO3-,该反应合理,故D不选;
故选B.
点评 本题考查离子反应发生的条件和弱电解质电离程度大小,明确电离平衡常数与酸性强弱关系、强酸制取弱酸原理是解本题关键,注意掌握离子方程式的书写原则.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应中旧化学键断裂需要吸收能量,新化学键形成需要放出能量,所以反应前后物质具有的总能量不变 | |
| B. | 上述热化学方程式中的△H的值与实验测定中反应物的用量无关 | |
| C. | 该反应的化学能可以转化为其他形式的能 | |
| D. | 反应物的总能量高于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2SO3溶液中加入硝酸酸化的Ba(NO3)2溶液,有白色沉淀出现,说明Na2SO3溶液已经变质 | |
| B. | 某溶液中加入盐酸产生无色气体,该气体能使澄清石灰水变浑浊,说明该溶液中一定有CO32- | |
| C. | 某溶液中加入BaCl2溶液,产生白色沉淀,加稀硝酸后,白色沉淀不溶解,也无其他现象,说明该溶液中一定含有SO42- | |
| D. | 取少量久置的Na2SO3样品溶于水,加足量盐酸有气体产生,然后加BaCl2溶液,产生白色沉淀,说明Na2SO3样品已部分变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:5 | B. | 5:3 | C. | 5:2 | D. | 5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,有机物  可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 | |
| B. | 1 mol  最多能与含3 mol NaOH的水溶液完全反应 最多能与含3 mol NaOH的水溶液完全反应 | |
| C. | 纤维素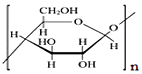 和壳聚糖 和壳聚糖 均属于多糖 均属于多糖 | |
| D. | 在一定条件下,1 mol的  最多能与含3 mol NaOH的溶液完全反应 最多能与含3 mol NaOH的溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{A+2m}$(A-N+m) mol | B. | $\frac{a}{A+m}$(A-N) mol | C. | $\frac{a}{A+m}$(A-N+m) mol | D. | $\frac{a}{A+2m}$(A-N+2m) mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com