
【题目】25℃时,体积均为20 mL、浓度均为0.1mol/L的两种酸HX、HY分别与0.1mol/L的NaOH溶液反应,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是

A. 加入10 mL NaOH溶液时,a点c(X-)<b点c(Y-)
B. b点溶液中,c(Y-)+2c(OH-)=c(HY)+2c(H+)
C. HY中加NaOH溶液至pH=7 时,所得溶液中c(Y-)=c(Na+)=c(OH-)=c(H+)
D. 25℃时,HX为强酸,HY为弱酸且Kb=10-8
【答案】B
【解析】根据图中信息可知,浓度均为0.1mol/L的两种酸HX、HY的pH分别1和4,则HX为强酸、HY为弱酸。A. 由于酸性HX>HY,当加入10 mL NaOH溶液时,生成的NaX和NaY的物质的量相等,但Y-水解的程度大,所以a点c(X-)>b点c(Y-),A错误;B. b点溶液中,NaY和HY的物质的量相等,根据电荷守恒可知: c(H+)+ c(Na+)=(Y-)+c(OH-),根据物料守恒可得:2c(Na+)=c(Y-)+ c(HY),两等式合并削去Na+,可得(Y-)+2c(OH-)=c(HY)+2c(H+),B正确;C. HY中加NaOH溶液至pH=7 时,根据电荷守恒:(Y-)+c(OH-)=c(H+)+ c(Na+)所得溶液中c(Y-)=c(Na+),c(OH-)=c(H+),但c(Na+)![]() c(OH-),C错误;D.根据图中信息可知,以没有加入氢氧化钠的点进行计算,该点HY的pH为4,c(Y-)=c(H+) =10-4mol/L,则Ka(HY)= 10-4
c(OH-),C错误;D.根据图中信息可知,以没有加入氢氧化钠的点进行计算,该点HY的pH为4,c(Y-)=c(H+) =10-4mol/L,则Ka(HY)= 10-4![]() 10-4/0.1=10-7的数量级为10-7,故D错误;综合以上分析,本题答案为:B。
10-4/0.1=10-7的数量级为10-7,故D错误;综合以上分析,本题答案为:B。


科目:高中化学 来源: 题型:
【题目】Cu3N具有良好的电学和光学性能,在电子工业领城、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的作用。
(1)Cu+的核外电子排布式为__________;N元素与O元素的第一电离能比较:N____O(填“>”、“<”或“=”)。
(2)与N3-含有相同电子数的四原子分子的空间构型为____________________。
(3)在Cu催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中醛其(![]() )碳原子的杂化方式为_________。
)碳原子的杂化方式为_________。
(4)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被C1-取代可生成Cu(H2O)2Cl2,试画出其具有极性的分子的结构式________________。
(5)Cu3N的晶胞结构如图所示,N3-的配位数为________;若晶胞棱长为anm,NA表示阿伏加德罗常数的值,则Cu3N的密度p=______g/cm3 [用含a 和NA 的式子表示,Mr(Cu3N)=206]

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应Al2O3+N2+3C ![]() 2AlN+3CO的叙述正确的是
2AlN+3CO的叙述正确的是
A. Al2O3是氧化剂,C是还原剂 B. 每生成1 mol CO需转移2 mol电子
C. AlN中氮元素的化合价为+3 D. N2发生了氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,依次通过的洗气瓶中盛放的试剂最好为( )
A.澄清石灰水、浓硫酸B.KMnO4酸性溶液、浓硫酸
C.溴水、浓硫酸D.浓硫酸、KMnO4酸性溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁元素在电化学中应用广泛。回答下列问题:
(1)根据反应2Fe3++Cu==2Fe2++Cu2+设计原电池如图。电流计显示电流方向为:a→b。

①电极B为____________,电解质溶液C为_____________。(填标号)
A,碳棒 B.铜片 C.Fe2(SO4)3溶液 D.CUSO4溶液
②A电极的电极反应式为________________________________________。
③用该电池做电源,电解硫酸钠溶液,当电解池阳极有11.2mL气体(标准状况)产生时,该电池有__________________molFe3+被还原。
(2)NaFeO4是一种用途广泛的化工产品,工业上常用电解法制取。制取装置如图。已知Na2FeO4只在强碱性条件下比较稳定,具有强氧化性。

①Na2FeO4中铁元素化合价为_____________ Na2FeO4是具有杀菌效果的净水剂。原因是_________________________________________________。
②电极Ni为_________________(填“阳”或“阴”)极。为使该装置能持续反应,离子交换膜应为__________________________(填“阳”或“阴”)离子交换膜。
③阳极反应式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过以下反应合成:Al2O3+N2+3C![]() 2AlN+3CO。有关该反应下列叙述正确的是
2AlN+3CO。有关该反应下列叙述正确的是
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. AlN中氮的化合价为+3
C. 上述反应中,每生成1 molAlN需转移3 mol电子
D. AlN的摩尔质量为41 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测
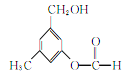
①可以使酸性高锰酸钾溶液褪色
②可以和NaOH溶液反应
③在一定条件下可以和乙酸发生反应
④在一定条件下可以发生消去反应
⑤在一定条件下可以和新制Cu(OH)2反应
⑥遇FeCl3溶液可以发生显色反应
其中正确的是( )
A. ①②③⑥ B. ①②③⑤ C. ①②③④ D. ①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C2H4O)是基础有机化工原料,由A可制备聚碳酸酯(D)及食用香精茉莉酮(部分反应条件略去)如下图所示:

已知A、B的核磁共振氢谱均只有1组峰
(1)A的名称为 _________ ;G中官能团的名称为 _______ 。
(2)②的反应类型为__________ ;③的反应类型为__________
(3)D的结构简式为 _______ 。
(4)反应①的化学方程式为 _______ 。
(5)G的一种同分异构体,能与FeCl3溶液发生显色反应,苯环上只有2个取代基且互为对位,则符合条件的异构体有 ____ 种,其中核磁共振氢谱只有5组峰的是 ___________(写结构简式)。
(6)依据上述合成路线,试以A和HC≡CLi为原料合成1,3-丁二烯(注明反应条件)_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】书写化学反应方程式是高中僧的必备技能,快来闯关吧!
(1)钠加入到三氯化铁溶液中发生的反应(总方程式):_________________________________________________________________
(2)过氧化钠与水的反应:_________________________________________________________________
(3)过氧化钠与二氧化碳的反应:_________________________________________________________________
(4)碳酸氢钠与氢氧化钠的反应: _________________________________________________________________
(5)碳酸氢钠受热分解: _________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com